
分析 已知温度每升高10℃,反应速率增大到原来的2倍,那么在50℃时,温度升高30℃,反应速率应是20℃的23倍=8倍,反应需要时间为原先的$\frac{1}{8}$,以此解答该题.
解答 解:化学反应中,升高温度,反应速率增大,20℃时,将1mL 0.1mol/L的Na2S2O3溶液和10mL 0.1mol/L的硫酸混合,2分钟后溶液中明显出现浑浊.即120s,已知温度每升高10℃,反应速率增大到原来的2倍,那么在50℃时,温度升高30℃,反应速率应是20℃的23倍=8倍,反应需要时间为原先的$\frac{1}{8}$,则同样的反应出现混浊需要的时间为$\frac{120s}{8}$=15s,
故答案为:15s
点评 本题考查化学反应速率的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握温度升高后速率的变化倍数,为解答该题的关键,难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、C1-、NO3- | B. | K+、Ag+、C1-、NO3- | ||
| C. | H+、Na+、CO32-、SO42- | D. | H+、Fe2+、C1-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

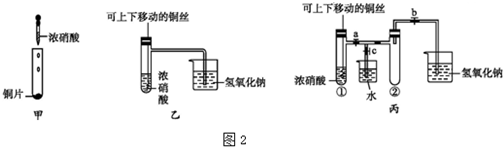
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳氢化合物的通式为CnH2n+2 | B. | 甲烷是一种比较洁净的能源 | ||
| C. | 石油的主要成分是碳氢化合物 | D. | 甲烷的二氯代物无同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{22.4ac}{M?1-c?}$ L | B. | $\frac{22.4c}{M}$ L | ||
| C. | $\frac{22.4ac}{1000b-Mc}$ L | D. | $\frac{22.4ac}{1000b}$ L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用50mL 12 mol•L-1的氯化氢水溶液与足量二氧化锰共热制取氯气 | |
| B. | 向100mL 3 mol•L-1的硝酸中加入5.6g铁 | |
| C. | 将1g铝片投入20mL 18.4 mol•L-1的硫酸中 | |
| D. | 常温常压下,0.1mol氯气通入1L水中反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
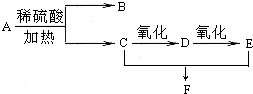 化合物A的分子式为C3H6O2,它有如图所示转化关系,已知D、E、F在加热条件下都能与碱性新制Cu(OH)2悬浊液生成砖红色沉淀:
化合物A的分子式为C3H6O2,它有如图所示转化关系,已知D、E、F在加热条件下都能与碱性新制Cu(OH)2悬浊液生成砖红色沉淀:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
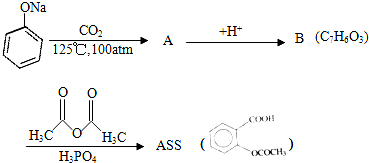
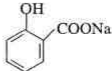 ;
;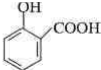 ;
;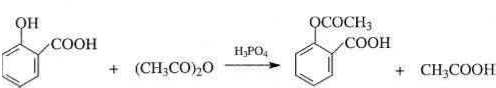 .
. .为了除去此物质,可在产物中加入饱和碳酸氢钠溶液溶液,再经过滤、酸化等步骤可得较纯净的ASS.
.为了除去此物质,可在产物中加入饱和碳酸氢钠溶液溶液,再经过滤、酸化等步骤可得较纯净的ASS.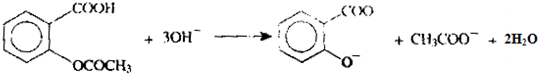
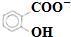 和CH3COO-)
和CH3COO-)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com