
【题目】按要求完成下列问题:
(1)分离胶体和溶液常用的方法叫______________。
(2)除去KNO3溶液中少量杂质AgNO3,可选择加入___________溶液,然后过滤。
(3)已知下列六种物质:熔融KI 、Cl2 、CaCO3固体 、食盐晶体、石墨 、盐酸 ,能导电的电解质是_______________。
(4)100克质量分数46%的酒精(C2H6O)水溶液中含氧原子_________NA。
(5)若ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是_________。
【答案】渗析 适量KCl 熔融KI 4 22.4bc/(aNA)L
【解析】
(1) 胶体的分散质粒子直径为1-100nm, 溶液中粒子的直径小于1nm,胶体的粒子不能透过半透膜,溶液中粒子可以透过半透膜,所以可以用渗析的方法把胶体和溶液分离开;答案:渗析。
(2)除去KNO3溶液中少量杂质AgNO3,可选择加入适量的KCl溶液,然后过滤即可;答案:适量KCl。
(3)电解质是在水溶液或熔融状态下能导电的化合物,如熔融KI、CaCO3固体 、食盐晶体属于电解质,能导电的是:熔融KI。答案:熔融KI。
(4)100克含酒精质量分数46%的溶液中含有乙醇的质量为:m(C2H6O)=100g![]() 46g,乙醇中含氧原子数N=46g /46g
46g,乙醇中含氧原子数N=46g /46g![]() mol-1
mol-1![]() NA=NA;水的质量m=100g-46g=54g, 水中含氧原子数N=54g/18g
NA=NA;水的质量m=100g-46g=54g, 水中含氧原子数N=54g/18g![]() mol-1
mol-1![]() NA=3NA;所以100克质量分数46%的酒精(C2H6O)水溶液中含氧原子NA +3NA =4NA。答案:4
NA=3NA;所以100克质量分数46%的酒精(C2H6O)水溶液中含氧原子NA +3NA =4NA。答案:4
(5)因为ag某气体中含有的分子数为b,所以a/M=b/NA,M=aNA/b,则cg该气的物质的量=c/M=bc/aNA mol,在标准状况下的体积是22.4![]() bc/(aNA)=22.4bc/(aNA)L,答案:22.4bc/(aNA)。
bc/(aNA)=22.4bc/(aNA)L,答案:22.4bc/(aNA)。


科目:高中化学 来源: 题型:
【题目】铁、铝的混合物进行如下实验:

(1)操作X的名称是________________;
(2)气体A是___________(填化学式);
(3)溶液B中阴离子除OH- 外还有__________(填离子符号),溶液D中存在的金属离子为_________(填离子符号);
(4)加入足量NaOH溶液时发生反应的离子方程式为:_________;加入稀盐酸发生反应的离子方程式为:___________________________________________;
(5)向溶液D加入NaOH溶液,观察到产生的白色絮状沉淀迅速变为灰绿色,最终变为红褐色,请写出沉淀转化的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于常温下pH=1的硝酸溶液,有关叙述:
①该溶液1mL稀释至100mL后,pH=3
②向该溶液中加入等体积、pH=13的氢氧化钡溶液恰好完全中和
③该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为1×10﹣12
④向该溶液中加入等体积、等浓度的氨水,所得溶液pH=7
其中正确的是
A. ①② B. ①③ C. ②④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中不正确的是
A. 某溫度时的混合溶液中C(H+) =![]() mol·L-1,说明该溶液呈中性(KW为该温度时水的离子积常数)
mol·L-1,说明该溶液呈中性(KW为该温度时水的离子积常数)
B. 常温下,由水电离出的c(H+)=10-12mol·L-1的溶液的PH可能为2或12
C. 已知Ksp(AgCl)=1.56×10-10。Ksp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO42-且浓度均为0.010mol·L-1溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,Cl-先产生沉淀
D. 常温下PH=7的CH3COOH和CH3COONa混合溶液中,c(Na+)=c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热HCOONa固体,发生的反应有:2HCOONa ![]() Na2C2O4+H2↑ ①
Na2C2O4+H2↑ ①
2HCOONa ![]() Na2CO3 +H2↑+CO↑ ②
Na2CO3 +H2↑+CO↑ ②
Na2C2O4 ![]() Na2CO3 + CO ↑ ③
Na2CO3 + CO ↑ ③
HCOONa加热分解时,固体失重率与温度的关系如右图所示。下列说法正确的是( )

A. T<415℃时,只有反应①发生
B. 反应①、②不可能同时发生
C. 570℃<T<600℃时,残留固体的主要成分是Na2CO3
D. 残留固体中m(Na2C2O4)=m( Na2CO3)时,反应①、②的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行气体x的性质实验,得出的实验结论正确的是
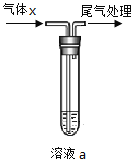
选项 | 实验操作 | 实验现象 | 实验结论 | |
制备气体x | 溶液a | |||
A | 乙醇与浓硫酸共热至170℃ | KMnO4酸性溶液 | 紫色褪去 | C2H4被氧化 |
B | 碳酸钠与醋酸溶液作用 | Na2SiO3溶液 | 产生白色沉淀 | H2CO3的酸性强于H2SiO3 |
C | 双氧水与二氧化锰作用 | KI淀粉溶液 | 溶液变蓝 | O2能将I-氧化为I2 |
D | 溴乙烷与氢氧化钠醇溶液共热 | Br2的四氯化碳溶液 | 橙红色褪去 | C2H4与Br2发生加成反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸(HCOOH)是一种可再生的储氢物质,其产生、储存和应用H2的循环示意图如下。

(1)HCOOH的结构式是________。
(2)产生H2:上图中光催化产生H2的化学方程式是________。
(3)储存H2:
Ⅰ.CO2加氢法:
①已知:2HCOOH (l) + O2 (g) = 2CO2 (g) + 2H2O (l) ΔH =-510 kJ·mol1
2H2 (g) + O2 (g) = 2H2O (l) ΔH =-572 kJ·mol1
则CO2 (g) + H2 (g) = HCOOH (l) ΔH =________。
此反应的化学平衡常数表达式:K=________。
②增大压强,CO2的平衡转化率升高,原因是________。
即使在高压和高温条件下,CO2的平衡转化率也不高,为实现CO2加氢向甲酸的高效转化还可以采取的措施是________。
Ⅱ.电化学还原法:
在碳酸氢盐的水溶液中,CO2还原成甲酸的原理如图1所示。

![]()

![]()
③图1中,阴极的电极反应式是________。
④依据图1,在图2的方框中填出相应物质的化学式或离子符号_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒温、恒容的密闭容器中存在化学平衡:H2(g)+I2(g) ![]() 2HI(g),已知H2和I2的起始浓度均为0.10molL-1,达到平衡状态时HI的浓度为0.16molL-1。若H2和I2的起始浓度均变为0.20molL-1,则平衡时H2的浓度为( )
2HI(g),已知H2和I2的起始浓度均为0.10molL-1,达到平衡状态时HI的浓度为0.16molL-1。若H2和I2的起始浓度均变为0.20molL-1,则平衡时H2的浓度为( )
A. 0.16molL-1 B. 0.08 molL-1 C. 0.04 molL-1 D. 0.02molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,Ⅰ、Ⅱ是两个完全相同的装置,分别装有10 mL相同浓度的盐酸,某学生分别在Ⅰ、Ⅱ的侧管中装入1.06 g Na2CO3和0.84 g NaHCO3,然后将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是
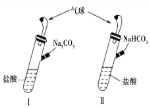
A. 装置Ⅰ的气球膨胀得快
B. 最终两试管中Na+、Cl-的物质的量分别相等
C. 若最终两气球体积不同,则盐酸的浓度一定小于或等于1 mol·L-1
D. 若最终两气球体积相同,则盐酸的浓度一定大于或等于2 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com