
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应:H2(g)+Br2(g)===2HBr(g) ΔH<0,平衡时Br2(g)
的转化率为a;若初始条件相同,绝热 下进行上述反应,平衡时Br2(g)的转化率为b,a与b的关系是 ( )
下进行上述反应,平衡时Br2(g)的转化率为b,a与b的关系是 ( )
A.a>b B.a=b C.a<b D.无法确定
科目:高中化学 来源: 题型:
在稀硫酸与锌反应制取氢气的实验中,探究加人硫酸铜
溶液的量对氢气生成速率的影响。实验中Zn粒过量且颗粒大小相同,饱和硫酸铜溶液用量0一4. 0mL,保
持溶液总体积为100. 0mL,记录获得相同体积(336 mL,)的气体所需时间,实验结果如图所示(气体体积均转
化为标况下)。据图分析,下列说法不正确的是

A.饱和硫酸铜溶液用量过多不利于更快收集氢气
B.a ,c两点对应的氢气生成速率相等
C.b点对应的反应速率为v( H2SO4)=1.0x10-3mol·L -1 ·s-1
D.d点没有构成原电池,反应速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
某乙醇水溶液的质量分数为w%,物质的量浓度为cmol/L ,密度为dg/mL,1Kg这种溶液中含有的乙醇是:
,密度为dg/mL,1Kg这种溶液中含有的乙醇是:
A.46C g B.c/d mol C.c mol D.1000dw g
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质分类正确的是
A.SO2、SiO2、 CO均为酸性氧化物
B.稀豆浆、硅酸、氯化铁溶液均为胶体
C.烧碱、冰醋酸、四氯化碳均为电解质
D.福尔马林、水玻璃、氨水均为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
生活和生产中常用到胶体的性质,请看下述三例:
(1)医学上治疗由肾功能衰竭等疾病引起的血液中毒时,最常用的血液 净化手段是血液透析。透析时,病人的血液通过浸在透析液中的透析膜进行循环和透析。透析原理同胶体的________类似,透析膜同________类似,透析膜的孔径应________(填“大于”“小于”或“等于”)血液内毒性物质粒子的直径,毒性物质才可能扩散到透析液中而被除去。
净化手段是血液透析。透析时,病人的血液通过浸在透析液中的透析膜进行循环和透析。透析原理同胶体的________类似,透析膜同________类似,透析膜的孔径应________(填“大于”“小于”或“等于”)血液内毒性物质粒子的直径,毒性物质才可能扩散到透析液中而被除去。
(2)在陶瓷工业上常遇到因陶土里混有氧化铁而影响产品质量的情况。解决方法之一是把这些陶土和水一起搅拌,使微粒直径在10-9~10-7m之间,然后插入两根电极,再接通直流电源。这时,阳极聚集_______,阴极聚集________,理由是______________________________。
(3)水泥和冶金工厂常用高压电对气溶胶作用除去大量烟尘,以减少对空气的污染,这种 做法运用了________原理。
做法运用了________原理。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于平衡体系mA(g)+nB(g) 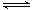 pC(g)+qD(g) △H<0。
pC(g)+qD(g) △H<0。
下列结论中错误的是
A.若温度不变,将容器的体积缩小到原来的一半,达到新平衡时A的浓度为原来的2.2倍,则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若m+n=p+q,则向含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a mol
D.保持其它条件不变,升高温度,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断PM2.5的酸碱性为 ,试样的pH值 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:H2(g)+1/2O2(g)=H2O(g)  H= -241.8KJ/mol
H= -241.8KJ/mol
C(s)+1/2O2(g)=CO(g)  H= -110.5KJ/mol
H= -110.5KJ/mol
写出焦炭与水蒸气反应的热化学方程式 ;
②洗涤含SO2的烟气,以下物质可作洗涤剂的是 ;
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化为:
①已知气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g)
2NO(g)  H>0
H>0
若1mol空 气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡。测得NO为8×10-4mol.计算该温度下的平衡常数K= ___________;汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是
气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡。测得NO为8×10-4mol.计算该温度下的平衡常数K= ___________;汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是  。
。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g)已知该反应的 H>
H> 0,简述该设想能否实现的依据 。
0,简述该设想能否实现的依据 。
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
温度为t ℃ 时,在体积为10 L的真空容器中通入1.00 mol氢气和1.00 mol碘蒸气,20 min后,反应达到平衡,此时测得碘蒸气的浓度为0.020 mol·L-1。涉及的反应可以用下面的两个化学方程式表示:
时,在体积为10 L的真空容器中通入1.00 mol氢气和1.00 mol碘蒸气,20 min后,反应达到平衡,此时测得碘蒸气的浓度为0.020 mol·L-1。涉及的反应可以用下面的两个化学方程式表示:
①H2(g)+I2(g)  2HI(g)
2HI(g)
②2H2(g)+2I2(g)  4HI(g)
4HI(g)
下列说法正确的是 ( )
A.反应速率用HI表示时,v(HI)=0.008 mol·L-1·min-1
B.两个化学方程式的意义相同,但其平衡常数表达式不同,不过计算所得数值相同
C.氢气在两个反应方程式中的转化率不同
D.第二个反应中,增大压强平衡向生成HI的方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是

A.a-b-c-d-e-e-f-g-h B.a-e-d-c-b-h-i-g
C.a-d-e-c-b-h-i-g D.a-c-b-d-e-h-i-f
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com