
| A. | 1mol氢气和1mol碘蒸气完全反应需要吸收26kJ的热量 | |
| B. | 1个氢分子和1个碘分子完全反应需要吸收52kJ的热量 | |
| C. | 1mol H2(g)与1mol I2(g)完全反应生成2mol的HI(g)需吸收52kJ的热量 | |
| D. | 1mol H2(g)与1mol I2(g)完全反应放出26kJ的热量 |
分析 A、焓变值是正值表明反应为吸热反应;
B、热化学方程式的系数表示物质的量的多少,不能表示微粒的数目;
C、$\frac{1}{2}$mol氢气和$\frac{1}{2}$mol碘单质气体完全反应生成1molHI吸手热量26KJ,则1 mol氢气和1 mol碘蒸气完全反应需要吸收52 kJ的热量;
D、焓变值是正值表明反应为吸热反应.
解答 解:A、$\frac{1}{2}$mol氢气和$\frac{1}{2}$mol碘单质气体完全反应生成1molHI吸手热量 26KJ,1 mol氢气和1 mol碘蒸气完全反应需要吸收52 kJ的热量,故A错误;
B、热化学方程式的系数表示物质的量的多少,不能表示分子的数目,故B错误;
C、$\frac{1}{2}$mol氢气和$\frac{1}{2}$mol碘单质气体完全反应生成1molHI吸手热量26KJ,则热化学方程式 H2(g)+I2(g)═2HI(g)△H=+52kJ•mol-1表示的意义:1molH2(g)与1molI2(g)完全反应生成2mol的HI气体需吸收52kJ的热量,故C正确;
D、热化学方程式 H2(g)+I2(g)═2HI(g);△H=+52kJ•mol-1中,焓变值是正值,表明反应为吸热反应,不会放出热量,故D错误.
故选C.
点评 本题考查学生热化学方程式的含义以及热化学方程式的书写知识,难度不大,注意基础知识的积累.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
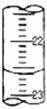 某学生用0.1000mol/L KOH溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
某学生用0.1000mol/L KOH溶液滴定未知浓度的盐酸,其操作可分解为如下几步:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16g CH4中含有10NA个电子 | |
| B. | 标准状况下,22.4 L HCl溶于水,所得溶液物质的量浓度是1.0mol/L | |
| C. | 将4gNaOH溶于100g蒸馏水,所得溶液物质的量浓度是1.0mol/L | |
| D. | 分子数为NA的CO、N2混合气体体积约为22.4 L,质量为28g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com