
分析 (1)根据锌和氢气之间的关系式计算锌减少的质量;
(2)根据氢气与电子的关系式计算;
(3)锌为负极,Cu为正极,正极上氢离子得电子生成氢气.
解答 解:(1)设锌减少的质量为m,
Zn+H2SO4=ZnSO4+H2↑
65g 22.4L
m 6.72L
m=19.5g
故答案为:19.5;
(2)设转移电子z,则
Zn+H2SO4=ZnSO4+H2↑ 转移电子
22.4L 2mol
6.72L z
所以z=0.6mol;
故答案为:0.6;
(3)锌为负极,Cu为正极,正极上氢离子得电子生成氢气,其电极方程式为:2H++2e-═H2↑;
故答案为:2H++2e-═H2↑.
点评 本题以原电池为载体考查了氧化还原反应的有关计算,明确各物理量间的关系以及电池中正负极的反应是解本题的关键,题目难度不大,侧重于考查学生的分析能力和计算能力.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:多选题
| A. | Na2S和HCl | B. | Na2S和H2SO4 | C. | Na2SO3和HCl | D. | Na2SO3和H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的低价氧化物能使Z单质的水溶液褪色 | |
| B. | X的氢化物溶于水显酸性 | |
| C. | 其离子半径大小:Z>Y>X | |
| D. | X的氢化物和Z的最高价氧化物对应的水化物不能反应生成盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机玻璃受热软化,易于加工成型,是一种硅酸盐材料 | |
| B. | 煤的气化是物理变化,是高效、清洁地利用煤的重要途径 | |
| C. | 纯银器在空气中久置变黑是因为发生了电化学腐蚀 | |
| D. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
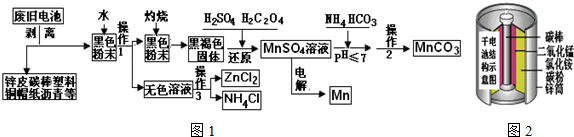
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Fe2+、Cr2O72-、SO42- | B. | Na+、OH-、SO42-、HCO3- | ||
| C. | K+、Mg2+、SO42-、OH- | D. | H+、K+、CO32-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com