
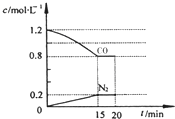
 回答下列问题:
回答下列问题:分析 (1)①根据v=$\frac{△c}{△t}$计算v(N2),根据n=△c×V计算生成N2的物质的量,根据方程式计算参加反应NO物质的量,进而计算NO的转化率;
②a.缩小容器体积,压强增大,平衡向正反应方向移动,移动结果不能消除CO浓度增大;
b.增加CO的量,CO的浓度增大;
c.降低温度,平衡向正反应方向移动;
增加NO的量,平衡正向移动;
d.扩大容器体积,压强减小,平衡向逆反应方向移动,平衡时CO浓度减小;
③改变起始投料量平衡时各物质体积分数仍然不变,说明与原平衡为等效平衡,正反应为气体体积减小的反应,恒温恒容下按化学计量数转化到方程式左边满足同种物质投料量相等,即满足n(NO)=2.0mol、n(CO)=2.4mol;
(2)Fe3+在溶液中水解显酸性,通过增大H+浓度的方式抑制Fe3+水解;
(3)①根据题目信息“生成可以杀菌消毒的物质”可知一种产物为HClO,根据守恒的原则,另一种产物为NH3;
②只有Cl元素化合价发生变化,根据氯气物质的量计算HCl物质的量,结合Cl元素化合价变化计算转移电子.
解答 解:(1)①由图可知,15min N2的浓度变化量为0.2mol/L,则v(N2)=$\frac{0.2mol/L}{15min}$=0.0133mol/(L•min),生成氮气为2L×0.2mol/L=0.4mol,则参加反应的NO为2×0.4mol=0.8mol,故NO的转化率为$\frac{0.8mol}{2mol}$×100%=40.0%,
故答案为:0.0133mol/(L•min);40.0%;
②a.缩小容器体积,压强增大,平衡向正反应方向移动,移动结果不能消除CO浓度增大,平衡时CO浓度增大,故a错误;
b.增加CO的量,CO的浓度增大,故b错误;
c.降低温度,平衡向正反应方向移动,CO浓度减小,故c正确;
d.扩大容器体积,压强减小,平衡向逆反应方向移动,但平衡时CO浓度减小,故d正确;
故选:cd;
③A.与原平衡相比压强增大,平衡正向移动,转化率增大,平衡时各物质的体积分数发生变化,故A错误;
B.等效为起始投入2molNO、2.2molCO,与原平衡不是等效平衡,故B错误;
C.转化到方程式左边可以得到2molNO、2.4molCO,与原平衡为等效平衡,故C正确;
D.不满足n(NO)=2.0mol、n(CO)=2.4mol,与原平衡不是等效平衡,故D错误,
故选:C;
(2)因为Fe3+存在水解平衡:Fe3++3H2O?Fe(OH)3+3H+,水解后溶液显酸性,所以通过增大H+浓度的方式抑制Fe3+水解,
故答案为:氯化铁溶液中存在如下平衡:Fe3++3H2O?Fe(OH)3+3H+,在盐酸中氢离子浓度较大,可使平衡逆向移动,抑制铁离子水解;
(3)①根据题目信息“生成可以杀菌消毒的物质”可知一种产物为HClO,根据守恒的原则,另一种产物为NH3,方程式为NH2Cl+H2O=HClO+NH3,
故答案为:NH2Cl+H2O=HClO+NH3;
②只有Cl元素化合价发生变化,化合价分别由0价变化为-1价、+1价,消耗氯气的物质的量为0.5mol,生成HCl为0.5mol,则转移电子0.5mol,故答案为:0.5.
点评 本题考查化学平衡计算与影响因素、化学反应速率的计算、等效平衡、盐类水解、氧化还原反应等,是对学生综合能力的考查,需要学生具备扎实的基础与灵活应用能力,难度中等.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
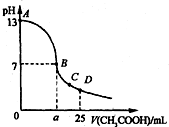 25℃时,在25mL 0.1mol•Lˉ1的NaOH溶液中,逐滴加入0.2mol•Lˉ1的CH3COOH溶液.溶液pH的变化曲线如图所示.下列分析的结论中,错误的是( )
25℃时,在25mL 0.1mol•Lˉ1的NaOH溶液中,逐滴加入0.2mol•Lˉ1的CH3COOH溶液.溶液pH的变化曲线如图所示.下列分析的结论中,错误的是( )| A. | C点时c(CH3COOˉ)>c(Na+)>c(H+)>c(OHˉ) | |
| B. | D点时c(CH3COO-)+c(CH3COOH)=2c(Na+) | |
| C. | 曲线上A、B间任一点,溶液中都有:c(Na+)>c(CH3COOˉ)>c(OHˉ)>c(H+) | |
| D. | B点的横坐标a>12.5 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:Na2CO3>NaHCO3 | |
| B. | 常温下的溶解性:Na2CO3>NaHCO3 | |
| C. | 与稀盐酸反应的剧烈程度:Na2CO3<NaHCO3 | |
| D. | 等质量的固体和足量的盐酸反应放出CO2的质量:Na2CO3>NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
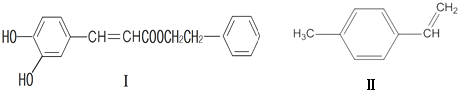
 或
或 (写1种);由Ⅳ生成Ⅱ的反应条件为NaOH的醇溶液、加热.
(写1种);由Ⅳ生成Ⅱ的反应条件为NaOH的醇溶液、加热.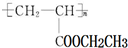 可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3.
可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 I.氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
I.氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成40.0LN2(标况) | B. | 有0.250molKNO3被氧化 | ||
| C. | 共生成0.625mol氧化物 | D. | 共转移电子1.25mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属元素的原子只有还原性,离子只有氧化性 | |
| B. | 金属元素在化合物中一定显正价 | |
| C. | 金属单质都可以和酸反应置换出氢气 | |
| D. | 金属元素的单质在常温下均为固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com