
| 1.8×10-10 |
| 0.3 |


科目:高中化学 来源: 题型:
| V |
| 2 |
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X、Y、Z、W的原子半径和原子序数都依次增大 |
| B、W、Z、M元素的气态氢化物热稳定性依次增强 |
| C、M分别和Y、Z所形成化合物都可以和碱反应 |
| D、X分别和M、W所形成的化合物含化学键类型一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
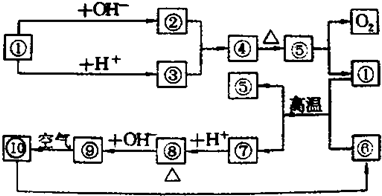
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、镁条在空气中燃烧生成的氧化物是MgO,则钠在空气中燃烧生成的氧化物是Na2O |
| B、元素周期表中,同一主族元素的性质具有一定的相似性和递变性.NaOH是强碱,则CsOH碱性更强 |
| C、由于键能E(N≡N)>E(Cl-Cl),故单质的沸点:N2>Cl2 |
| D、SO2通入BaCl2溶液无明显现象,则SO2通入Ba(NO3)2溶液也无明显现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com