
【题目】臭氧很多实用特性,其强氧化性常用于消毒杀菌和防腐保鲜。目前制取臭氧的方法很多,其中高压放电法(DBD)和电解纯水法原理如图所示。下列说法中错误的是

A.两种方法都是将电能转化为化学能
B.高压放电法和电解纯水法相比,会产生污染性的NOx气体
C.电解纯水时,阳极发生的电极反应有3H2O-6e-=O3↑+6H+
D.电解纯水时,H+由电极b流向电极a
科目:高中化学 来源: 题型:
【题目】已知AG=lg![]() ,电离度α=
,电离度α=![]() ×100%。常温下,向10mL0.1mol/LHX溶液中滴加0.1mol/LNaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。
×100%。常温下,向10mL0.1mol/LHX溶液中滴加0.1mol/LNaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。
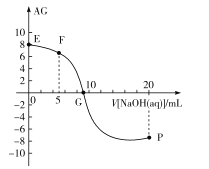
下列说法错误的是( )
A.F点溶液pH<7
B.G点溶液中c(Na+)=c(X-)>c(H+)=c(OH-)
C.V=10时,溶液中c(OH-)<c(HX)
D.常温下,HX的电离度约为1%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中,完全正确的一组是( )
①用试管夹夹持试管时,将试管夹从试管底部往上套,夹在试管的中上部
②给盛有液体的体积超过![]() 容积的试管加热
容积的试管加热
③把鼻孔靠近容器口去闻气体的气味
④将试管平放,用纸槽往试管里送入固体粉末后,再竖立试管
⑤取用放在细口瓶中液体时,取下瓶塞倒放在桌面上,倾倒液体时,瓶上的标签对着地面
⑥配制一定物质的量浓度溶液的容量瓶必须先干燥
⑦用坩埚钳夹取加热后的蒸发皿
⑧将胶头滴管垂直伸进试管内滴加液体
⑨稀释浓硫酸时,把水迅速倒入盛有浓硫酸的量筒中
⑩检验装置的气密性时,把导管一端浸入水中,用手捂住容器的外壁或用酒精灯微热.
A.①④⑦⑩B.①④⑤⑦⑩C.①④⑤⑦⑧⑩D.④⑤⑦⑧⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I已知下列热化学方程式:
①H2(g)+![]() O2(g)═H2O(l);△H=-285.8kJmol-1
O2(g)═H2O(l);△H=-285.8kJmol-1
②H2(g)+![]() O2(g)═H2O(g);△H=-241.8kJmol-1
O2(g)═H2O(g);△H=-241.8kJmol-1
③CO(g)═C(s)+![]() O2(g);△H=+110.5kJmol-1
O2(g);△H=+110.5kJmol-1
④C(s)+O2(g)═CO2(g);△H=-393.5kJmol-1
回答下列问题:
(1)上述反应中属于放热反应的是_________________
(2)H2的燃烧热△H=___________________
(3)燃烧10gH2生成液态水,放出的热量为________________
(4)表示CO燃烧热的热化学方程式为.________________
II已知:(1)P4(s,白磷)+5O2(g)==P4O10(s)△H1=-2983.2kJ/mol
(2)P(s,红磷)+ ![]() O2(g)=
O2(g)= ![]() P4O10(s) △H1=-738.5kJ/mol,则白磷转化为红磷的热化学方程式_________________。相同的状况下,能量较低的是_________________;白磷的稳定性比红磷_________________(填“高”或“低”)
P4O10(s) △H1=-738.5kJ/mol,则白磷转化为红磷的热化学方程式_________________。相同的状况下,能量较低的是_________________;白磷的稳定性比红磷_________________(填“高”或“低”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(s)+B(g) ==3C(g)+4D(g)反应中,表示该反应速率最快的是
A. υ(A)=1.5 mol·L1·s1B. υ(B)=0.5 mol·L1·s1
C. υ(C)=0.8 mol·L1·min1D. υ(D)=4mol·L1·min1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mo1)随时间t(min)的变化如图1所示。已知达平衡后,降低温度,A的体积分数将减小。
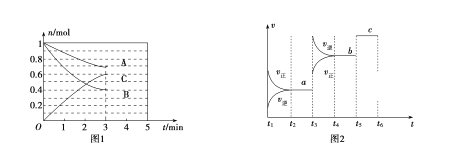
(1)该反应的化学方程式为__________________,此反应平衡常数的表达式为K=________。
(2)从开始到最初达到平衡,C的平均反应速率v(C)=________________。3min时,A的转化率=________%。该反应的![]() ________0。(填“
________0。(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”)
”)
(3)对于该反应改变某些条件,化学反应速率及化学平衡状态可能会发生变化,请回答:
①恒温恒容充入惰性气体,平衡______移动(填“正向”、“逆向”或“不”,下同)
②恒温恒压充入惰性气体,平衡______移动,化学反应速率_______(填“加快”或“减慢”)
③升高温度,平衡______移动。
(4)该反应的反应速率v随时间t的关系如图2所示:
①根据图2判断,在t3时刻改变的外界条件是_______,t5时刻改变的外界条件是_______。
②a、b、c三个阶段中,C的体积分数最大的是________,
③a、b、c三个阶段的平衡常数分别用K1、K2、K3表示则:K1、K2、K3 之间的关系为___________(用“![]() ”、“
”、“![]() ”或“
”或“![]() ”连接)。
”连接)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
(1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:

4种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是__.
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.

①写出基态Cu原子的核外电子排布式__;金属铜采用下列__(填字母代号)堆积方式.

②写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来)__.
③水分子间存在氢键,请你列举两点事实说明氢键对水的性质的影响__.
④SO42﹣的空间构型是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是工业上常用的硫化剂,已知
是工业上常用的硫化剂,已知![]() 中硫元素显
中硫元素显![]() 价,它不稳定,在水中易发生岐化反应,易溶于有机溶剂。实验室常用
价,它不稳定,在水中易发生岐化反应,易溶于有机溶剂。实验室常用![]() 与纯净的氯气制备
与纯净的氯气制备![]() 。反应涉及到的几种物质的熔沸点如下:
。反应涉及到的几种物质的熔沸点如下:
物质 |
|
|
|
|
沸点 | 47 |
| 77 | 137 |
熔点 |
|
|
|
|
实验室利用下列装置制备![]() (部分夹持仪器己略去):
(部分夹持仪器己略去):
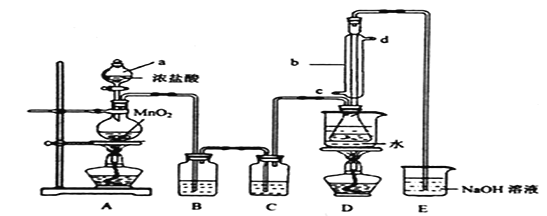
回答下列问题:
(1)装置中b玻璃仪器的名称为_________;写出制备![]() 的化学方程式_________。
的化学方程式_________。
(2)D中采用热水浴加热的原因是 _________,反应结束后从锥形瓶内混合物中分离出产品的方法是______。
(3)实验过程中,若缺少C装置,则发现产品浑浊不清,出现该现象的原因化学方程式表示为______________。
(4)该实始装置设计存在缺陷,你的改进建议是 _________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com