
| A. | 苯中混有溴,加入KI 溶液,振荡,用 CCl4萃取出溴 | |
| B. | 乙烷中混有乙烯,通过氢气在一定条件下反应,使乙烯转化为乙烷 | |
| C. | 硝基苯中混有浓 HNO3 和浓 H2SO4,将其倒入到 NaOH 溶液中,静置,分液 | |
| D. | 乙烯中混有 SO2,将其通入酸性 KMnO4 溶液中洗气 |
分析 A.溴氧化KI生成碘,易溶于苯,且四氯化碳与苯混溶;
B.乙烯与氢气发生加成,但乙烷中易引入新杂质氢气;
C.酸与NaOH反应后,与硝基苯分层;
D.二者都与高锰酸钾发生氧化还原反应.
解答 解:A.溴氧化KI生成碘,易溶于苯,且四氯化碳与苯混溶,应加入氢氧化钠溶液除杂,故A错误;
B.乙烯与氢气发生加成,但甲烷中易引入新杂质氢气,应选溴水、洗气除杂,故B错误;
C.酸与NaOH反应后,与硝基苯分层,然后分液可分离,故C正确;
D.二者都与高锰酸钾发生氧化还原反应,应用氢氧化钠溶液除杂,故D错误.
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应及混合物分离方法选择为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识与实验相结合,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 元素周期表有7个周期、18个族 | |
| B. | 天然气是一种清洁的化石燃料 | |
| C. | 工业上常用电解NaCl水溶液的方法制取金属钠 | |
| D. | 淀粉和纤维素互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.
用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.| 假设 | 实验操作 | 预期现象 | 结论 |
| 起催化作用的是CuSO4溶液中的SO42- | 向盛有2mL5%的H2O2溶液的试管中滴加入少量的2mol/LH2SO4溶液,并把带火星的木条伸入试管. | 无明显现象 | 起催化作用的不是SO42- |
| 起催化作用的是CuSO4溶液中的Cu2+ | 向盛有2mL5%的H2O2溶液的试管中滴加入少量的CuSO4溶液,并把带火星的木条伸入试管. | 试管中有大量气泡产生,带火星的木条复燃 | 起催化作用的是Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
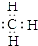 ;②Cl-的结构示意图:
;②Cl-的结构示意图: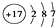 ;③乙烯的分子式:CH2=CH2④中子数为20的氳原子:${\;}_{17}^{37}$Cl;⑤乙酸分子的比例模型:
;③乙烯的分子式:CH2=CH2④中子数为20的氳原子:${\;}_{17}^{37}$Cl;⑤乙酸分子的比例模型: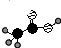 ;⑥氯乙烷的结构式:
;⑥氯乙烷的结构式: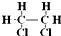
| A. | ④ | B. | ③④⑤ | C. | ④⑤⑥ | D. | ①③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
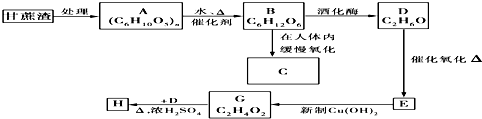
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能/(kJ•mol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
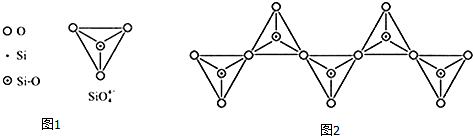
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-和NO3- | B. | O3和SO2 | C. | CO2和NO2- | D. | SCN-和N3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质的盐析是可逆过程 | |
| B. | 变性是蛋白质的凝固 | |
| C. | 盐析和变性都能够改变蛋白质的性质 | |
| D. | 盐析和变性都可以通过加入盐来实现 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com