
【题目】已知反应![]() 的能量变化如图所示,下列说法正确的是
的能量变化如图所示,下列说法正确的是
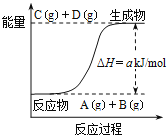
A.该体系的压强不变时标志此反应处于平衡状态
B.若该反应中有电子得失,则可设计成原电池
C.反应物的总键能高于生成物的总键能
D.该反应中的反应物A和B的转化率一定相同
 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】将一定量的氯气通入50mL 10.00 mol·L-1的氢氧化钠浓溶液中,加热少许时间后,溶液中只有NaCl、NaClO、NaClO3三种溶质。下列说法正确的是
A.与NaOH反应的氯气物质的量:0.25mol<n(Cl2)<0.5mol
B.若反应中转移的电子为n mol,则0.25<n<0.5
C.溶液中n(Na+):n(Cl-)可能为7:5
D.溶液中n(NaCl):n(NaClO):n(NaClO3)可能为10:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图![]() 甲不一定在丁、庚的连线上
甲不一定在丁、庚的连线上![]() ,戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是
,戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是

A.甲与己形成的化合物一定是离子化合物
B.简单气态氢化物的稳定性:庚![]() 己
己![]() 戊
戊
C.乙、丙、丁的最高价氧化物水化物可以相互反应
D.庚的最高价氧化物水化物酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,Z元素的核电荷数为X与Y元素核电荷数之和。下列说法正确的是

A.氢化物稳定性Y比W强,是因为Y的氢化物中存在氢键
B.XY2、XW2、ZY2熔沸点依次增大,都是由共价键形成的分子晶体
C.一定条件下,X单质能与ZY2反应生成Z单质,说明X的非金属性比Z强
D.根据元素周期律,可以推测T元素的单质具有半导体特性,钠能与T形成Na2T2化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列三种有机物是某些药物中的有效成分:


以下说法正确的是( )
A.三种有机物都能与浓溴水发生反应
B.三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种
C.将等物质的量的三种物质加入氢氧化钠溶液中,阿司匹林消耗氢氧化钠最多
D.使用FeCl3溶液和稀硫酸不能鉴别出这三种有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是 ( )
A.C(s)+O2(g)=CO2(g) ΔH1 C(s)+![]() O2(g)=CO(g) ΔH2
O2(g)=CO(g) ΔH2
B.S(g)+O2(g)=SO2(g) ΔH3 S(l)+O2(g)=SO2(g) ΔH4
C. 2H2(g)+O2(g)=2H2O(l) ΔH5 H2(g)+![]() O2(g)=H2O(l) ΔH6
O2(g)=H2O(l) ΔH6
D.CaCO3(s)=CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)=Ca(OH)2(s) ΔH8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性小组决定用实验探究的方法证明化学反应具有一定的限度。取5mL 0.1mol/L KI溶液于试管中,滴加0.1mol/L FeCl3溶液2mL,发生如下反应:2Fe3++2I-![]() 2Fe2++I2。为证明该反应具有可逆性且具有限度,他们设计了如下实验:
2Fe2++I2。为证明该反应具有可逆性且具有限度,他们设计了如下实验:
①取少量反应液,滴加AgNO3溶液,发现有少量黄色沉淀(AgI),证明反应物没有反应完全;
②再取少量反应液,加入少量CCl4,振荡,发现CCl4层显浅紫色,证明萃取到I2,即有I2生成。综合①②的结论,他们得出该反应具有一定的可逆性,在一定条件下会达到反应限度。
(1)老师指出他们上述实验中①不合理,你认为是_____________________________;在不改变反应物用量的前提下,改进的方法是_____________________________________________。
(2)有人认为步骤②适合检验生成I2较多的情况下,还有一种简便方法可以灵敏地检验是否生成了I2,这种方法是______________________________。
(3)控制适合的条件,将反应2Fe3++2I-![]() 2Fe2++I2,设计成如图所示的原电池。
2Fe2++I2,设计成如图所示的原电池。

①反应开始时,乙中石墨电极上发生____________(填“氧化”或“还原”)反应,电极反应式为_________________________。
②电流计读数为0时,反应达到平衡状态。此时在甲中加入FeCl2固体,发现电流计又发生偏转,则甲中的石墨作_______(填“正”或“负”)极,该电极的电极反应式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸的酸式盐NaHY的水溶液中,HY-的电离程度小于HY-的水解程度,有关叙述中正确的是( )
A.H2Y在电离时为:H2Y+H2O![]() HY-+H3O+
HY-+H3O+
B.在该盐的溶液中,离子浓度为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
C.在该盐的溶液中,离子浓度为:c(Na+)>c(HY-)>c(Y2-)>c(OH-)>c(H+)
D.HY-的水解方程式为:HY-+H2O![]() H3O++Y2-
H3O++Y2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。某化学研究小组利用Al2O3+3C+N2![]() 2AlN+3CO制取氮化铝,设计如图实验装置:
2AlN+3CO制取氮化铝,设计如图实验装置:

试回答:
(1)实验中用饱和NaNO2与NH4Cl溶液制取氮气的化学方程式为___。
(2)装置中分液漏斗与蒸馏烧瓶之间的导管A的作用是__(填写序号)。
a.防止NaNO2饱和溶液蒸发
b.保证实验装置不漏气
c.使NaNO2饱和溶液容易滴下
(3)按图连接好实验装置,检查装置气密性的方法是:在干燥管D末端连接一导管,将导管插入烧杯中的液面下,___。

(4)化学研究小组的装置存在严重问题,请说明改进的办法:___。
(5)反应结束后,某同学用如图装置进行实验来测定氮化铝样品的质量分数(实验中导管体积忽略不计)。已知:氮化铝和NaOH溶液反应生成NaAlO2和氨气。
①广口瓶中的试剂X最好选用___(填写序号)。
a.汽油 b.酒精 c.植物油 d.CCl4
②广口瓶中的液体没有装满(上方留有空间),则实验测得NH3的体积将___(填“偏大”、“偏小”或“不变”)。
③若实验中称取氮化铝样品的质量为10.0g,测得氨气的体积为3.36L(标准状况),则样品中AlN的质量分数为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com