
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是( )

A. 汉黄芩素的分子式为C16H13O5
B. 该物质遇FeCl3溶液不显色
C. 1 mol该物质与溴水反应,最多消耗2 mol Br2
D. 与足量H2发生加成反应后,该分子中官能团的种类减少1种
科目:高中化学 来源: 题型:
【题目】锰酸锂(LiMn2O4)可作为锂离子电池的正极材料,在工业上可利用软锰矿浆(主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等杂质)吸收含硫烟气(主要成分SO2)制备锰酸锂,生产流程:

已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强。
②在此流程中部分金属阳离子生成氢氧化物沉淀的pH如表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)含硫烟气在通入软锰矿浆前需要先冷却,冷却的原因是____________________。
(2)滤液1中所含金属阳离子有_____________(填离子符号)。
(3)在实际生产中,Li2CO3与MnO2按物质的量之比1∶4混合均匀加热制取LiMn2O4,反应过程:
①升温到515℃时,Li2CO3开始分解产生CO2和碱性氧化物A,写出A的名称________,此时比预计Li2CO3的分解温度(723℃)低得多,可能原因是_______________;
②升温到566℃时,MnO2开始分解产生另一种气体X,X恰好与①中产生的CO2物质的量相等,同时得到固体B,固体B是______。
③升温到720℃时,第三阶段反应开始,固体质量逐渐增加,当质量不再增加时,得到高纯度的锰酸锂。请写出该阶段反应的化学方程式_________________。
(4)由“滤液1”得到“滤液2”同时回收Al(OH)3的实验方案如下:边搅拌边向滤液1中加入_____________,再加入NaOH溶液调节pH范围为____________,过滤得到滤液2和滤渣,向滤渣中加入NaOH溶液pH≥12,搅拌、过滤,再向所得滤液中通入过量的CO2过滤、洗涤、低温烘干得Al(OH)3。
(5)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是__________,宜选用_____(“阳”或“阴”)离子交换膜。
②b中,生成Li2CO3反应的化学方程式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述不正确的是
A.28gN2所含分子数为NA
B.0.2 mol/L Na2SO4中所含Na+ 数为0.4NA
C.标准状况下11.2L H2中所含原子数为NA
D.0.5mol CH4和1mol H2O中所含氢原子数均为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应N2+3H2![]() 2NH3在10L恒容密闭容器中进行,测得2min内,H2的物质的量由20mol减少到8mol,则2min内NH3的化学反应速率为
2NH3在10L恒容密闭容器中进行,测得2min内,H2的物质的量由20mol减少到8mol,则2min内NH3的化学反应速率为
A.0.4mol·(L·min)1B.1.8mol·(L·min)1
C.1.2mol·(L·min)1D.0.6mol·(L·min)1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液X,由Na+、Ag+、Ba2+、Al3+、Fe3+、AlO2﹣、CO32﹣、SO42﹣中的若干种离子组成,取该溶液进行如下实验:
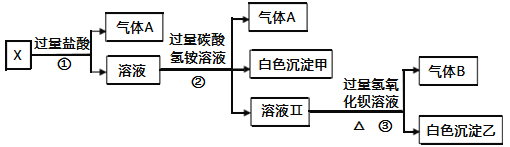
(1)气体A的成分是________(填化学式,下同),气体B的成分是________。
(2)写出步骤①发生反应的所有离子方程式________________________。
(3)写出步骤②形成白色沉淀甲的离子方程式________________________。
(4)通过上述实验,可确定X溶液中一定存在的离子是________,尚未确定是否存在的离子是________,只要设计一个简单的后续实验就可以确定该离子是否存在,该方法是________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将一定量的气体通入体积为2L的密闭容器中,使其发生反应,有关物质X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是

A.t时,X、Y、Z的质量不再改变
B.该反应的化学方程式为:3Z=3X+2Y
C.t时,Z的浓度为1.2mol/L
D.t时,反应停止,反应速率为0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三周期元素,浓度均为0.01mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示。则下列说法正确的是( )

A.气态氢化物的稳定性:N>R
B.Z的最高价氧化物对应的水化物能溶于稀氨水
C.Y和R形成的化合物既含离子键又含共价键
D.X和M两者最高价氧化物对应的水化物反应后溶液的pH>7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是我们生活中必不可少的物质。将NaCl固体溶于水,溶解过程如图所示,下列说法正确的是
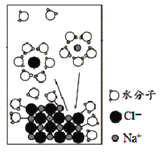
A.该过程发生了分解反应
B.离子从固体表面脱离后不会再回到固体表面
C.水合Na+的图示不科学
D.NaCl溶于水后发生了电离,是在通电条件下进行的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图装置中发生反应的离子方程式为:Zn+2H+=Zn2++H2↑,下列说法错误的是
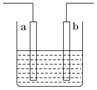
A. a、b不可能是同种材料的电极
B. 该装置可能是电解池,电解质溶液为稀盐酸
C. 该装置可能是原电池,电解质溶液为稀盐酸
D. 该装置可看作是铜-锌原电池,电解质溶液是稀硫酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com