
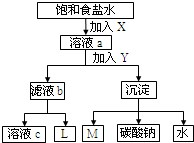
| A、若是氨碱法,溶液c可在转化流程中循环利用 |
| B、若是联碱法,则L的主要成分是NH3 |
| C、M可在转化流程中循环利用 |
| D、X是NH3,Y是CO2 |
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4CNO |
| B、(NH4)2CO3 |
| C、CH3COONH4 |
| D、NH4NO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4LH2O中含有的分子数为NA |
| B、常温常压下,32gO2中含有的分子数为NA |
| C、1molMg与足量N2反应时转移的电子数为NA |
| D、1L1mol?L-1CaCl2溶液中含有的氯离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 32 | 52 | 90 | 120 |
| 固体质量/g | ① | 83 | 74 | 65 |
| 固体物质化学式 | CoCl2?6H2O | ② | ③ | CoCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将木炭粉碎成粉末状可以加快化学反应速率 |
| B、升高温度可以加快化学反应速率 |
| C、增加压强不能加快化学反应速率 |
| D、增加木炭的量可以加快化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
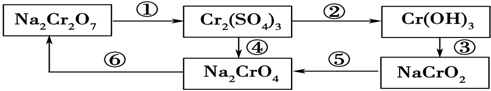
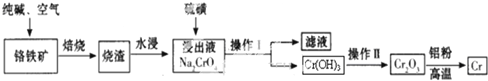
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com