
【题目】高聚物的合成与结构修饰是制备具有特殊功能材料的重要过程。下图是合成具有特殊功能高分子材料W(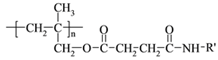 )的流程:
)的流程:
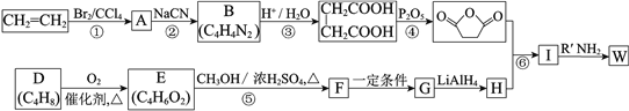
已知:(R、R1、R2代表烃基)
I、![]()
![]() RCH2OH
RCH2OH
II、![]()
⑴反应①的反应类型是_______________。
⑵反应②是取代反应,其化学方程式是___________________________________________。
⑶D的核磁共振氢谱中有两组峰且面积之比是1:3,不存在顺反异构。D的结构简式是______。
⑷反应⑤的化学方程式是__________________________________________________。
⑸G的结构简式是__________________。
⑹反应⑥的化学方程式是__________________________________________________。
⑺工业上也可用![]() 合成E。由上述①~④的合成路线中获取信息,完成下列合成路线(箭头上注明试剂和反应条件,
合成E。由上述①~④的合成路线中获取信息,完成下列合成路线(箭头上注明试剂和反应条件,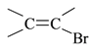 不易发生取代反应)__________________
不易发生取代反应)__________________
![]()
【答案】 加成反应 BrCH2CH2Br +2NaC→ NCCH2CH2CN + 2NaBr (CH3)2C=CH2 CH2=C(CH3)COOH + HOCH3 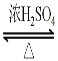 CH2=C(CH3)COOCH3 + H2O
CH2=C(CH3)COOCH3 + H2O 
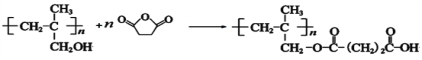
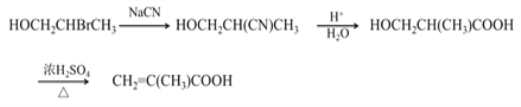
【解析】根据反应条件![]() ,结合W的结构
,结合W的结构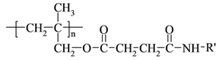 可知I为
可知I为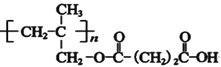 ,由此可知H为
,由此可知H为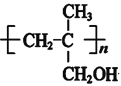 ,再结合信息I可知G为
,再结合信息I可知G为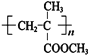 ,相应的单体F为CH2=C(CH3)COOCH3,E和CH3OH酯化反应得到F,则E的结构为CH2=C(CH3)COOH;
,相应的单体F为CH2=C(CH3)COOCH3,E和CH3OH酯化反应得到F,则E的结构为CH2=C(CH3)COOH;
⑴反应①是乙烯与Br2发生加成反应生成BrCH2CH2Br;
⑵反应②BrCH2CH2Br与NaCN发生取代反应生成NCCH2CH2CN,其化学方程式是 BrCH2CH2Br +2NaCN→ NCCH2CH2CN + 2NaBr;
⑶C4H8的核磁共振氢谱中有两组峰且面积之比是1:3,说明有2个甲基,且不存在顺反异构,说明不饱和碳上连有相同基团,则D的结构简式是(CH3)2C=CH2;
⑷反应⑤是CH2=C(CH3)COOH 与 HOCH3发生的酯化反应,其化学方程式是CH2=C(CH3)COOH + HOCH3 ![]() CH2=C(CH3)COOCH3 + H2O ;
CH2=C(CH3)COOCH3 + H2O ;
⑸G的结构简式是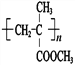 ;
;
⑹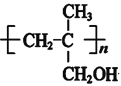 和
和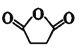 发生反应的化学方程式是
发生反应的化学方程式是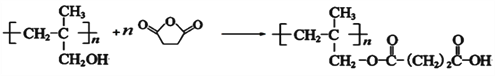 ;
;
⑺结合①~④的合成路线中获取信息,用![]() 合成CH2=C(CH3)COOCH3 的流程为
合成CH2=C(CH3)COOCH3 的流程为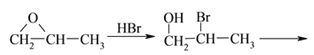
![]()
![]()
![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列指定微粒的个数比为2∶1的是( )。
A.Be2+中的质子和电子
B.H原子中的中子和质子
C.NaHCO3中的阳离子和阴离子
D.BaO2(过氧化钡)固体中的阴离子和阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知钍![]() 的原子可发生下列放射性变化:
的原子可发生下列放射性变化: ![]() →
→![]() +
+ ![]() ,生成的X是与Mg同主族的一种元素的原子,下列对X的推断不正确的是
,生成的X是与Mg同主族的一种元素的原子,下列对X的推断不正确的是
A. X元素位于第六周期 B. X的氢氧化物是一种强碱
C. X的碳酸盐难溶于水 D. X的最高化合价为+2价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知拆开或形成1 mol化学键所吸收或放出的能量叫做该化学键的键能,单位kJ·mol-1。白磷在氧气中燃烧的化学方程式可用结构式表示为如图所示:
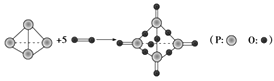
试根据下表中的化学键键能计算0.1molP4(白磷)在氧气中充分燃烧放出能量_____kJ。
化学键 | P—P | P—O | O=O | P=O |
键能/kJ·mol-1 | 198 | 360 | 498 | 585 |
Ⅱ.化学能在一定条件下能够转化为电能,构成原电池。
(1)根据构成原电池的本质判断,如下反应可以设计成原电池的是_________(填序号)。
A. 2FeBr2 + 3Cl2 = 2FeCl3+2Br2
B. Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
C. 2H2O = 2H2↑+O2↑
D. Cu+2AgNO3 = 2Ag+Cu(NO3)2
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验。
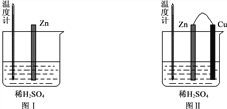
有关实验现象,下列说法正确的是:_____________(填序号)。
图Ⅰ中气泡产生在锌棒表面,Ⅱ中产生在铜棒表面
图Ⅰ和图Ⅱ的气泡均产生在锌棒表面
两图中生成气体的速率几乎一样快
图Ⅱ中产生气体的速度比Ⅰ快
温度计显示的均为室温
图Ⅱ中温度计的示数高于图Ⅰ的示数
图Ⅰ中温度计的示数高于图Ⅱ的示数
图Ⅰ和图Ⅱ中温度计的示数相等,且均高于室温
(3)铅蓄电池是最常见的二次电池,放电时的化学方程式为:Pb(s) + PbO2(s) + 2H2SO4(aq) = 2PbSO4(s) + 2H2O。负极反应式为____________________,一段时间后,负极增重48克,转移电子_______mol。
(4)如图是甲烷燃料电池原理示意图,回答下列问题:
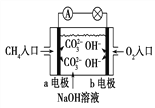
①电池的负极反应式为: ____________。
②电池工作一段时间后电解质溶液的pH__________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.用化学用语回答下列问题:
(1)写出二氧化碳分子的电子式:_____________;
(2)写出氮气分子的结构式____________。
Ⅱ.下列物质:①N2 ②CO2 ③NH3 ④Na2O ⑤Na2O2 ⑥NaOH ⑦CaBr2 ⑧H2O2 ⑨NH4Cl ⑩HBr。
含有极性键和非极性键的是_______;
含有非极性键的离子化合物是_____。(填序号,下同)
Ⅲ.下列变化中:①干冰气化;②硝酸钾熔化;③KHSO4熔融;④硫酸溶于水;⑤蔗糖溶于水;⑥HI分解;⑦碘升华;⑧溴蒸气被木炭吸附。
(1)未破坏化学键的是_____________;
(2)仅离子键被破坏的是_____________;
(3)仅共价键被破坏的是_____________。
Ⅳ.下列物质:①1H、2H、3H ;②H2O、D2O、T2O;③O2、O3;④14N、14C
(1)互为同位素的是:______;
(2)互为同素异形体的是:______;
氢的三种原子1H、2H、3H 与氯的两种原子35Cl、37Cl相互结合为氯化氢,可得分子中相对分子质量不同的有________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要的化工产品及工业原料。
某温度下,合成氨反应的平衡常数K=3.0×103(mol/L)-1,
(1)写出其对应的化学方程式________________________
(2)某温度下,如果在体积恒定为10L的密闭容器中充入:0.1molN2、0.1molH2和2molNH3则反应_______(填“正向进行”或“逆向进行”或“达到平衡”)。
(3)该温度下,在体积恒定为10L的四个密闭容器中分别充入下列物质,反应达到平衡后,N2的转化率最大的是____________(填字母代号)。
A.10mol N2、30mol H2和20mol NH3
B.10mol N2和30mol H2
C.20mol N2和60mol H2
D.10mol N2和28mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠( NaCl02)是一种高效氧化剂和漂白剂,主要用于棉纺、纸张漂白、食品消毒、水处理等。已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2![]() 3H2O,高于38 ℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。纯ClO2易分解爆炸。一种制备亚氯酸钠粗产品的工艺流程如下:
3H2O,高于38 ℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。纯ClO2易分解爆炸。一种制备亚氯酸钠粗产品的工艺流程如下:
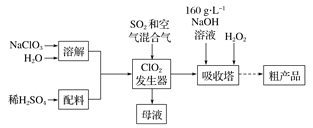
(1) ClO2发生器中的离子方程式为 ,发生器中鼓人空气的作用可能是__________(选填序号)。
a.将SO2氧化成SO3,增强酸性
b.稀释ClO2以防止爆炸
c.将NaClO3还原为ClO2
(2)吸收塔内反应的化学方程式为 ,吸收塔的温度不能超过20℃,其原因是_____________。
(3)从“母液”中可回收的主要物质是 。
(4)从吸收塔中可获得NaCl02溶液,从NaCl02溶液到粗产品(NaClO2)经过的操作步骤依次为:①减压,55℃蒸发结晶;② ;③ ;④低于60℃干燥,得到成品。
(5)为测定粗品中NaCl02的质量分数,做如下实验:
准确称取所得亚氯酸钠样品10.00 g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴人适量的稀硫酸,充分反应(ClO2-+ 4I-+ 4H+= 2H2O+ 2I2+ Cl-)。将所得混合液配成250mL待测溶液,取25.00 mL待测液,用2.000 mol.L-lNa2S203标准液滴定(I2+2S2O32-= 2I-+S4O62-),测得消耗Na2SO3溶液平均值为16.40mL。该样品中NaClO2的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com