
 A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构.
A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构.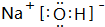 CB2的电子式为
CB2的电子式为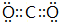
分析 A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子,则A为H元素;B是地壳中含量最多的元素,则B为O元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火,则B为碳元素;D+具有与Ne原子相同的电子层结构,则D为Na,据此解答.
解答 解:A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子,则A为H元素;B是地壳中含量最多的元素,则B为O元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火,则C为碳元素;D+具有与Ne原子相同的电子层结构,则D为Na.
(1)A、B、C、D四种元素的名称分别为氢、氧、碳、钠,故答案为:氢、氧、碳、钠;
(2)由A、B、D三种元素组成的化合物为NaOH,电子式为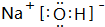 ,CO2的电子式为
,CO2的电子式为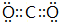 ,故答案为:
,故答案为: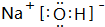 ;
;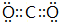 ;
;
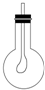
(3)如图所示,在烧瓶中收集满CO2气体,用带导管(导管一端事先绑好一个气球)的胶塞塞紧,当打开胶塞迅速倒入浓的NaOH溶液后,立即塞紧胶塞振荡,可观察到气球逐渐膨胀,原因是:氢氧化钠溶液稀释二氧化碳,使烧瓶内压强减小,
故答案为:气球膨胀;氢氧化钠溶液稀释二氧化碳,使烧瓶内压强减小.
点评 本题考查结构性质位置关系应用,涉及电子式、化学实验等,侧重考查学生对知识的迁移应用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Al3+、Ag+、NO3-、I- | B. | Mg2+、NH4+、NO3-、Cl- | ||
| C. | NH4+、K+、I--、Br- | D. | Zn2+、Na+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.| t/K | 300 | 400 | … |
| K/(mol/L)-2 | 4×106 | 8×107 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +519.4 kJ•mol-1 | B. | +259.7 kJ•mol-1 | C. | -259.7 kJ•mol-1 | D. | -519.4 kJ•mol-l |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol CO32- | B. | 0.5mol Na+ | C. | 3.01×1023个Na+ | D. | 3.01×1023个O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com