
 已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子.
已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子. .
.分析 A的周期数等于其主族序数,则A为H元素,B原子的价电子排布为nsnnpn,n=2,则B为C元素,D是地壳中含量最多的元素,则D为O元素,C的原子序数介于碳、氧之间,则C为N元素,E是第四周期的p区元素且最外层只有2对成对电子,外围电子排布为4s24p4,则E为Se元素,F元素原子序数为29,则F为Cu,据此解答.
(1)E的外围电子排布为4s24p4,结合泡利原理、洪特规则画出价电子排布图;
(2)同周期元素从左到由元素的第一电离能呈增大增大,N原子2p亚层属于半充满的稳定结构,难失去一个电子,第一电离能大于元素的;
(3)CO32-中心原子形成3个σ键,孤电子对数为$\frac{6-2×3}{2}$=0,杂化轨道数目为3,NH4+中心原子形成4个σ键,空间构型为正四面体;
(4)CN-与N2为等电子体,含有C≡N键,三键含有1个σ键、2个π键;
(5)元素的非金属性越强,键能越大,对应的氢化物越稳定;
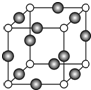
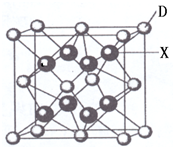
(6)由晶胞结构可知,N原子位于顶点,Cu位于棱上,利用均摊法计算晶胞中N、Cu原子数目,进而确定化学式;晶胞中位于顶点和棱心的位置最近,则N原子的配位数是6,
若相邻C原子和F原子间的距离为a nm,则边长为2a nm,表示出晶胞质量,根据ρ=$\frac{m}{V}$计算.
解答 解:A的周期数等于其主族序数,则A为H元素,B原子的价电子排布为nsnnpn,n=2,则B为C元素,D是地壳中含量最多的元素,则D为O元素,C的原子序数介于碳、氧之间,则C为N元素,E是第四周期的p区元素且最外层只有2对成对电子,外围电子排布为4s24p4,则E为Se元素,F元素原子序数为29,则F为Cu.
(1)E是第四周期的p区元素且最外层只有2对成对电子,外围电子排布为4s24p4,价电子排布图为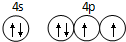 ,故答案为:
,故答案为: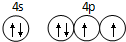 ;
;
(2)同周期元素从左到由元素的第一电离能呈增大增大,由于O原子核外价电子排布式2s22p4,N原子核外价电子排布式2s22p3,2p亚层属于半充满的稳定结构,难失去一个电子,第一电离能大于元素,则顺序为N>O>C,故答案为:N>O>C;
(3)CO32-中心原子形成3个σ键,孤电子对数为$\frac{6-2×3}{2}$=0,杂化轨道的类型为sp2,NH4+中心原子形成4个σ键,空间构型为正四面体,
故答案为:sp2;正四面体;
(4)CN-与N2为等电子体,含有C≡N键,则1mol BC-中含有π键的数目为2NA,故答案为:2;
(5)非金属性O>S,元素的非金属性越强,键能越大,对应的氢化物越稳定,则H2O>H2Se,
故答案为:H2O;H2Se;H2O中共价键的键能高于H2Se;
(6)由晶胞结构可知,N原子位于顶点,晶胞中N个数为8×$\frac{1}{8}$=1,Cu位于棱上,晶胞中Cu原子个数为12×$\frac{1}{4}$=3,则化学式为Cu3N,晶胞中位于顶点和棱心的位置最近,则N原子的配位数是6,
若相邻C原子和F原子间的距离为a nm,则边长为2a nm,晶胞的体积为(2a×10-7 cm)a3,晶胞的质量为$\frac{206}{{N}_{A}}$g,则密度为$\frac{206}{{N}_{A}}$g÷(2a×10-7 cm)a3=$\frac{103}{4{a}^{3}×1{0}^{-21}×{N}_{A}}$g/cm3,
故答案为:Cu3N; 6;$\frac{103}{4{a}^{3}×1{0}^{-21}×{N}_{A}}$g.
点评 本题考查物质的结构与性质,涉及核外电子排布、电离能、杂化方式、空间构型、化学键、元素周期律应用、晶胞计算等,难度中等,注意掌握利用均摊法进行晶胞的有关计算.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
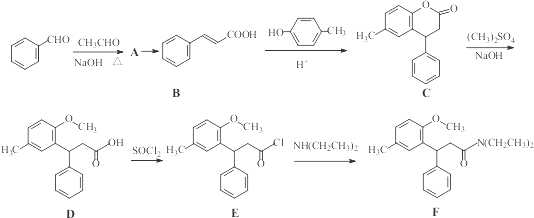
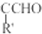
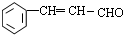 .
.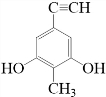 等.(任写一种)
等.(任写一种)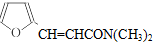 )是一种高效麻醉剂,写出以
)是一种高效麻醉剂,写出以 、CH3CHO、NH(CH3)2为原料制备呋喃丙胺的合成路线流程图(无机试剂自选).合成路线流程图示例如下:
、CH3CHO、NH(CH3)2为原料制备呋喃丙胺的合成路线流程图(无机试剂自选).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
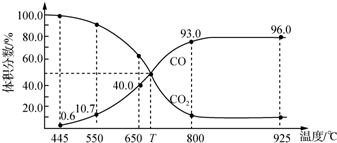
| A. | 550℃时,若充入惰性气体,v(正)、v(逆)均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 | |
| D. | 925℃时,此反应的平衡常数K=2 304,保持温度不变,若缩小体积,K值将变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC 2的晶体为离子晶体,其阳离子与阴离子的个数比为1:1,D的二价阳离子比C的简单阴离子多一个电子层.AC 2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E原子序数为26.回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示).
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC 2的晶体为离子晶体,其阳离子与阴离子的个数比为1:1,D的二价阳离子比C的简单阴离子多一个电子层.AC 2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E原子序数为26.回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某条件下可逆反应达到限度之前,逆反应速率逐渐增大可能与生成物浓度逐渐增大有关 | |
| B. | 可逆反应的限度不随反应条件的改变而改变 | |
| C. | 化学反应的限度决定了反应物在该条件下的最大转化率 | |
| D. | 炼铁高炉尾气中CO含量不随高炉高度改变而改变,是因为有关反应达到了限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维应避免在强碱环境中使用 | |
| B. | 船体镀锌或镀锡均可保护船体,镀层破损后将立即失去保护作用 | |
| C. | 利用碳酸酯聚合材料生产一次性饭盒,可以减少对环境产生的白色污染 | |
| D. | 油脂皂化生成的高级脂肪酸钠是肥皂的有效成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫在氧气中燃烧,发出明亮的蓝紫色火焰,生成有刺激性气味的气体 | |
| B. | 碳在空气中燃烧,发出白光,生成使澄清石灰水变浑浊的气体 | |
| C. | 红磷在空气中燃烧,产生大量白色烟雾 | |
| D. | 将分别装有氨水和酚酞溶液的两只烧杯靠近,氨水先变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com