
| A. | X>Y>Z | B. | X>Z>Y | C. | Z>X>Y | D. | Y>Z>X |
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
 某原电池的装置如图所示,总反应为H2(g)+HgO(s)=H20(1)+Hg(1),其中阴离子交换膜只允许阴离子和水分子通过.下列说法正确的是( )
某原电池的装置如图所示,总反应为H2(g)+HgO(s)=H20(1)+Hg(1),其中阴离子交换膜只允许阴离子和水分子通过.下列说法正确的是( )| A. | 正极反应为:HgO(s)-2e-+H20=Hg(l)+2OH- | |
| B. | 放电结束后,溶液中的pH值下降 | |
| C. | 每反应2.24L氢气,交换膜通过0.2mol离子 | |
| D. | 电子通过离子交换膜从负极向正极移动,保持溶液中电荷平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | 只有③ | C. | ③④⑤ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8gNa2O2中所含有的阴离子数目是0.2NA | |
| B. | 标准状况下,2.24L18O2中含有的中子的数目是NA | |
| C. | 在20℃、1.01×105 Pa时,2.8g C2H4和CO的混合气体含气体分子数是0.1 NA | |
| D. | 标准状况下,a L CH4和a L C6H14中所含分子数均约为$\frac{a{N}_{A}}{22.4}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
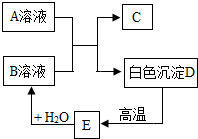 A、B、C、D、E为初中化学常见的物质,相互之间存在以下转化关系.其中A是一种盐,广泛应用于玻璃、造纸、纺织和洗涤剂的生产等;D是大理石的主要成分,大量用于建筑业.请回答:
A、B、C、D、E为初中化学常见的物质,相互之间存在以下转化关系.其中A是一种盐,广泛应用于玻璃、造纸、纺织和洗涤剂的生产等;D是大理石的主要成分,大量用于建筑业.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4溶液中c(Na+)=c(OH-)+c(HSO${\;}_{4}^{-}$)+2c(SO${\;}_{4}^{2-}$) | |
| B. | 混合后溶液pH值为13 | |
| C. | 混合溶液中c(Ba2+)+c(Na+)+c(H+)=c(SO${\;}_{4}^{2-}$)+c(OH-) | |
| D. | 加入Ba(OH)2溶液后混合溶液水电离程度比纯水的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com