
科目:高中化学 来源: 题型:选择题
| A. | 在1.8g18O2中含有NA个质子 | |
| B. | 28gC2H4中含有4NA个C-H键 | |
| C. | 常温下,2.7g铝片投入足量的稀硫酸中,铝失去的电子数为0.3NA | |
| D. | 4.6gNa完全转化成Na2O和Na2O2的混合物,生成物中阴离子总数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
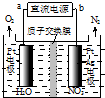 发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.
发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇既是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇既是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BC胶体区别于其他分散系的本质特征是丁达尔现象 | |
| B. | 将小烧杯中25mL蒸馏水加至沸腾,向沸水中逐滴加入5~6滴氯化铁饱和溶液,继续煮沸至溶液呈红褐色沉淀,停止加热,以制取Fe(OH)3胶体 | |
| C. | Fe(OH)3胶体粒子在电场影响下将向阴极运动,说明Fe(OH)3胶体带正电 | |
| D. | 往Fe(OH)3胶体中逐滴加入稀H2SO4溶液时,开始时会出现凝聚,再继续逐滴加时,沉淀又会消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
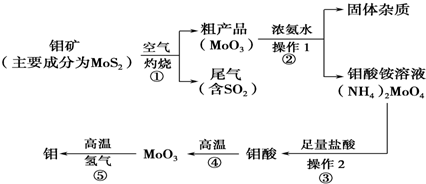
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
| c/mol•L-1 | 0 | 0.036 | 0.030 | 0.026 | 0.022 | 0.017 | 0.016 | 0.015 | 0.015 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,相同体积的物质,它们的物质的量必相等 | |
| B. | 任何条件下,等物质的量的N2和CO所含的分子数必相等 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 铁的摩尔质量在数值上等于铁原子的相对原子质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com