
(14分) 二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用左下图所示装置模拟工业制取并收集ClO2。

(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式: 。
(2)A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、 ;B也必须添加温度控制装置,应该是 (选填“冰水浴”或“热水浴”)装置。
(3)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据右上图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2的操作步骤:
① ;② ;③洗涤;④干燥。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进
行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol·L—1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
(已知2 Na2S2O3 + I2 = Na2S4O6 + 2NaI)
①滴定过程中,至少须进行两次平行测定的原因是 。
②原ClO2溶液的浓度为 g / L(用步骤中的字母代数式表示)。
(14分)
(1)2KClO3 + H2C2O4 K2 CO3 + CO2↑+ 2ClO2↑+ H2O(2分)
(2)温度计(2分) 冰水浴(2分)
(3)①蒸发结晶(2分) ②趁热过滤(2分)
(4)①减少实验误差(1分) ②135cV2/ V1(3分)
【解析】
试题分析:(1)加热60℃,氯酸钾和草酸反应生成碳酸钾、二氧化碳、二氧化氯和水,反应方
程式为:2KClO3+H2C2O4 = K2CO3+CO2↑+2ClO2↑+H2O。
(2)要控制温度必须使用温度计测量温度,二氧化氯的熔点较低,为收集二氧化氯,应在较低温度下进行,所以应该采用冰水浴,故答案为:温度计;冰水浴。
(3)从溶液中制取溶质,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO2?3H2O,应趁热过滤
(4)为减少实验误差,应采用多次实验的方法,
设原ClO2溶液的浓度为x,
2ClO2 ~ 5I2 ~ 10Na2S2O3
2mol 10mol
10?2x×V1×10?3/0.1 mol 1×10-3cV2mol
x=2cV2/ V1 mol?L?1=135cV2/ V1 g/L。
考点:本题考查实验方案的设计、实验基本仪器和基本操作、方程式的书写、化学计算。


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源:2015届浙江省杭州市高三10月月考化学试卷(解析版) 题型:选择题
下列实验设计能完成或实验结论合理的是
A.证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾-淀粉试纸检验,观察试纸颜色的变化
B.铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,铝热剂中一定不含铁的氧化物
C.测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较
D.用浓硫酸吸收二氧化硫中混有少量SO3气体
查看答案和解析>>
科目:高中化学 来源:2015届浙江省慈溪市、余姚市高三上学期期中联考化学试卷(解析版) 题型:选择题
发现元素周期律的科学家是
A.爱因斯坦 B.居里夫人 C.门捷列夫 D.侯德榜
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期第二次质量检测化学试卷(解析版) 题型:选择题
在下列各溶液中,离子一定能大量共存的是
A.强碱性溶液中: K+、Al3+、Cl-、SO42-
B.由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,Na+、K+、Cl-、HCO3-
C.强碱性的溶液中:CO32-、Na+、AlO2-、NO3-
D.酸性溶液中:Fe2+、Al3+、NO3-、I-
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期第二次质量检测化学试卷(解析版) 题型:选择题
下列说法正确的是
A.酸性氧化物都是非金属氧化物
B.碱性氧化物都是金属氧化物
C.由同种元素构成的物质一定属于纯净物
D.难溶于水的电解质一定是弱电解质
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期第一次统练化学试卷(解析版) 题型:选择题
海洋中蕴藏着丰富资源,对它的开发利用有利于缓解当前资源紧张的困局,工业上从海水中提取的某些无机物的简易流程可以用下图表示:

下列有关说法不正确的是
A.氯碱工业中采用阳离子交换膜电解槽,可以防止氯气与碱的反应
B.第②步中结晶出的MgCl2·6H2O不能采用直接在空气中受热分解制无水MgCl2
C.第①步常采用往母液中加浓NaOH溶液来获取Mg(OH)2
D.从第③步到第⑤步的目的是获得含溴单质浓度较高的溶液
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期第一次统练化学试卷(解析版) 题型:选择题
已知NH4CuSO3与足量的1mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法合理的是
A.NH4CuSO3中硫元素被氧化了
B.刺激性气味的气体是二氧化硫或氨气
C.该反应中NH4CuSO3既是氧化剂又是还原剂
D.该反应中硫酸既表现为酸性又表现氧化性
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期期中联考化学试卷(解析版) 题型:填空题
(每空2分,共10分)
研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s) + 3C(石墨) = 2Fe(s) + 3CO(g) △H 1 = +489.0 kJ·mol-1
C(石墨) +CO2(g) = 2CO(g) △H 2 = +172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K= 。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应经过相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的ΔH 0(填“>”、“<”或“=”)。
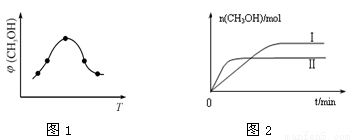
③在两种不同温度下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”、“<”或“=”)。
④用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三10月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.石油干馏可得到汽油、煤油等
B.破坏乙烯分子里C=C键所需吸收的能量是破坏乙烷分子里C—C键能量的两倍
C.油脂不是高分子化合物,1mol油脂完全皂化生成1mol甘油和3 mol高级脂肪酸
D.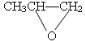 和CO2反应生成可降解聚合物
和CO2反应生成可降解聚合物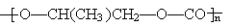 ,该反应符合绿色化学的原则
,该反应符合绿色化学的原则
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com