
分析 已知2mol•L-1的盐酸10mL,则n(HCl)=2mol/L×0.01L=0.02mol,根据HCl与NaOH的反应关系计算NaOH的物质的量,再根据m=nM计算.
解答 解:已知2mol•L-1的盐酸10mL,则n(HCl)=2mol/L×0.01L=0.02mol,HCl与NaOH恰好完全反应,则n(NaOH)=0.02mol,
所以m(NaOH)=nM=0.02mol×40g/mol=0.8g;
答:含有NaOH的质量是0.8g.
点评 本题考查化学方程式的有关计算,题目难度不大,侧重考查学生分析计算能力,注意把握反应方程式中各物质之间的关系以及物质的量的计算公式.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
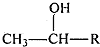
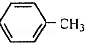 $\stackrel{KMnO_{4},H+}{→}$
$\stackrel{KMnO_{4},H+}{→}$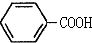
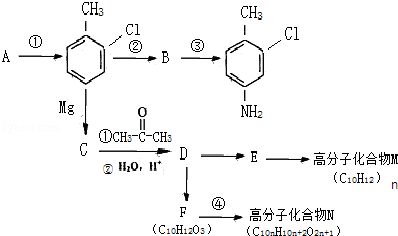
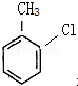 这一途径外,另一途径生成的中间产物的结构简式为
这一途径外,另一途径生成的中间产物的结构简式为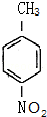 ,假定每次反应所得可能产物的机会是均等的,试分析,当消耗等量反应物时题中(填“题中”或“另一”)途径获得B的产量更高;
,假定每次反应所得可能产物的机会是均等的,试分析,当消耗等量反应物时题中(填“题中”或“另一”)途径获得B的产量更高;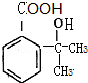 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$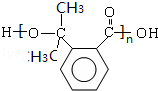 +(n-1)H2O;
+(n-1)H2O;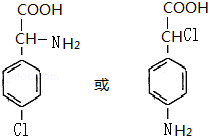 等.
等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
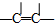 | ─C≡C─ | ─CH3 | ─CH2CH3 或─C2H5 | ─OH | ─CHO | ─COOH | -COO-R |

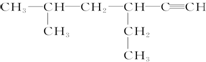
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
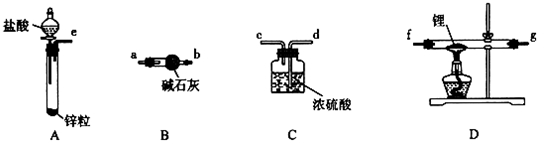
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 火力发电厂的煤经粉碎、脱硫处理 | B. | 电镀废液经中和后直接排入到农田 | ||
| C. | 聚乳酸塑料代替传统塑料作购物袋 | D. | 回收并合理处理聚氯乙烯塑料废物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水污染的程度是由其溶氧量来测定 | |
| B. | 污染水的金属元素如汞、镉、铅等的含量极少时,不会对生物造成伤害 | |
| C. | 使用含磷洗衣粉会造成河水、湖水污染,使海藻疯狂生长,鱼类死亡 | |
| D. | 工业所排出的废水危害水生生物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阿伏加德罗常数是12 g碳中所含的碳原子数 | |
| B. | 24 g镁的原子最外层电子数为NA | |
| C. | 阿伏加德罗常数约是6.02×1023 | |
| D. | 阿伏加德罗常数的符号为NA,近似为6.02×1023 mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 中和时所需NaOH的量 | B. | 电离的程度 | ||
| C. | H+的物质的量浓度 | D. | H+的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去N2中的少量O2,可通过灼热的Cu网后,收集气体 | |
| B. | 除去FeCl3溶液中Fe(OH)3沉淀可以过滤 | |
| C. | 除去乙醇中的少量NaCl,可用蒸馏的方法 | |
| D. | 重结晶不能用于提纯物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com