
【题目】在1200℃时,天然气脱硫工艺中会发生下列反应
H2S(g)+3/2 O2(g)=SO2(g)+H2O(g) △H1
2H2S(g)+SO2(g)=3/2 S2(g)+2H2O(g) △H2
H2S(g)+1/2O2(g)=S(g)+H2O(g) △H3
2S(g)=S2(g) △H4
则△H4正确表达式为( )
A. △H4=2/3(△H1+△H2-3△H3) B. △H4=2/3(3△H3-△H1-△H2)
C. △H4=3/2(△H1+△H2+3△H3) D. △H4=3/2(△H1-△H2-3△H3)
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:
Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH1=+489.0 kJ·mol-1,
C(s) +CO2(g)=2CO(g) ΔH2=+172.5kJ·mol-1
则CO(g)还原Fe2O3(s)的热化学方程式为____。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:_____。
(3)将CO2和H2充入1L的密闭容器中,在两种温度下发生反应:
CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g)测得CH3OH的物质的量随时间的变化见图1。
CH3OH(g) +H2O(g)测得CH3OH的物质的量随时间的变化见图1。
①该反应的平衡常数表达式为K=___。
②曲线I、Ⅱ对应的平衡常数大小关系为KⅠ___KⅡ(填“>”或“=”或“<”)。
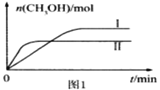
③一定温度下,往该容器中投入1 molCO2、3 mol H2 ,一段时间后达到平衡。若平衡后气体的压强为开始的0.8倍,则CO2的平衡转化率=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据如图判断,下列说法正确的是( )
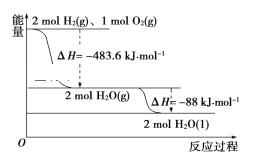
A. 氢气的燃烧热ΔH=-241.8 kJ·mol-1
B. 2 mol H2(g)与1mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量低
C. 液态水分解的热化学方程式为2H2O(l)=2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
D. H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,回答下列问题:
(1)在反应N2(g)+3H2(g) ![]() 2NH3(g)中,若以N2表示的该反应的化学反应速率为0.2 mol/(L·min),则以H2表示此反应的化学反应速率为 _____________ mol/(L·min)
2NH3(g)中,若以N2表示的该反应的化学反应速率为0.2 mol/(L·min),则以H2表示此反应的化学反应速率为 _____________ mol/(L·min)
(2)在5 L的恒容密闭容器中,充人0.1 mol N2和0.4 mol H2,在一定条件下发生反应,2s后测得N2的物质的量为0.09mol,则以NH3的浓度变化表示的反应速率为 ___________ mol/(L·s)
(3)将0.2 mol NH3充人容积为10 L的恒容密闭容器中,某温度下发生反应2NH3(g)![]() N2(g) + 3H2(g),在0~2s内,消耗NH3的平均速率为0.002 mol/(L·s),则在2s时,容器中生成_____________molH2,此时NH3的物质的量浓度为______________ mol/L。
N2(g) + 3H2(g),在0~2s内,消耗NH3的平均速率为0.002 mol/(L·s),则在2s时,容器中生成_____________molH2,此时NH3的物质的量浓度为______________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 lmol碳完全燃烧后可放出393.5KJ的热量,下列热化学方程式正确的是( )
A.C(s)+O2(g)=CO2(g) △H=+393.5kJ/mol
B.C(s)+![]() O2(g)=CO(g) △H=﹣393.5kJ/mol
O2(g)=CO(g) △H=﹣393.5kJ/mol
C.C+O2=CO2 △H=﹣393.5kJ/mol
D.C(s)+O2(g)=CO2(g) △H=﹣393.5kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴主要以Br- 形式存在于海水(呈弱碱性)中,利用空气吹出法从海水中提溴,工艺流程示意如下。
![]()
资料:常温下溴呈液态,深红棕色,易挥发。
(1)酸化:将海水酸化的主要目的是避免_______(写离子反应方程式)。
(2)脱氯:除去含溴蒸气中残留的Cl2
①具有脱氯作用的离子是_______。
②溶液失去脱氯作用后,补加FeBr2或加入_______,脱氯作用恢复。
(3)富集、制取Br2:
用Na2CO3溶液吸收溴,Br2歧化为BrO3- 和Br-。再用H2SO4酸化歧化后的溶液得到Br2,其离子反应方程式为_______。
(4)探究(3)中所用H2SO4浓度对Br2生成的影响,实验如下:
序号 | A | B | C |
试剂组成 | 1 mol/L NaBr 20% H2SO4 | 1 mol/L NaBr 98% H2SO4 | 将B中反应后溶液用水稀释 |
实验现象 | 无明显现象 | 溶液呈棕红色,放热 | 溶液颜色变得很浅 |
①B中溶液呈棕红色说明产生了_______。
②分析C中溶液颜色变浅的原因,甲同学认为是发生了化学反应所致;乙同学认为是用水稀释所致。若认为甲同学的分析合理,请用具体的反应说明理由;若认为乙同学的分析合理,进一步设计实验方案说明。理由或方案:_______。
③酸化歧化后的溶液宜选用的酸是______(填“稀硫酸”或“浓硫酸”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两位学生利用原电池反应检测金属的活动性顺序,两人都使用镁片与铝片作电极,但甲同学将电极放入6 mol·L-1硫酸溶液中,乙同学将电极放入6 mol·L-1的氢氧化钠溶液中,如下图所示。
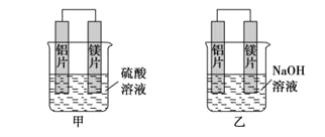
(1)写出甲池中正极的电极反应式_______________________________________。
(2)写出乙池中负极的电极反应式________________________________________。
(3)写出乙池中总反应的离子方程式_______________________________________。
(4)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强(填写元素符号)。
(5)由此实验,可得到如下哪些结论正确(____)
A.利用原电池反应判断金属活动顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动顺序已过时,已没有实用价值
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析
(6)上述实验也反过来证明了“直接利用金属活动顺序判断原电池中的正负极”这种做法________(可靠或不可靠)。如不可靠,请你提出另一个判断原电池正负极的可行实验方案________________(如可靠,此空可不填)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com