
A、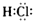 |
B、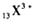 |
C、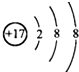 |
D、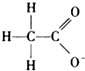 |
科目:高中化学 来源: 题型:
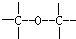 ④
④
查看答案和解析>>
科目:高中化学 来源: 题型:
 NOx是汽车尾气中的主要污染物之一.通过NOx传感器可监测NOx的含量,其工作原理示意图如下.下列说法正确的是( )
NOx是汽车尾气中的主要污染物之一.通过NOx传感器可监测NOx的含量,其工作原理示意图如下.下列说法正确的是( )| A、Pt电极作负极,NiO电极作正极 |
| B、Pt电极上发生的是氧化反应 |
| C、NiO电极上发生的是还原反应 |
| D、NiO电极的电极反应式为NO+O2--2e-═NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2+、Cl-、NO3-、OH- |
| B、H+、Ba2+、Mg2+、SO42- |
| C、OH-、Na+、Mg2+、SO42- |
| D、Na+、K+、MnO4-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 .现有乙酰水杨酸的粗品,某同学用中和法测定产品纯度:取a g产品溶解于V1 mL 1mol/L的NaOH溶液中,加热使乙酰水杨酸水解,再用1mol/L的盐酸滴定过量的NaOH,当滴定终点时消耗盐酸V2 mL;
.现有乙酰水杨酸的粗品,某同学用中和法测定产品纯度:取a g产品溶解于V1 mL 1mol/L的NaOH溶液中,加热使乙酰水杨酸水解,再用1mol/L的盐酸滴定过量的NaOH,当滴定终点时消耗盐酸V2 mL;查看答案和解析>>
科目:高中化学 来源: 题型:
| 【实验方案】 | 【现象】 | 【结论】 |
| ①分别取等量的热水和冷水于试管中 分别加入CuSO4固体 |
CuSO4固体在热水中溶解较快 | 温度越高,固体溶解速率越快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com