
| A. | n=$\frac{{M}_{2}-2{M}_{1}}{58}$ | B. | n=$\frac{{M}_{2}-{M}_{1}}{29}$ | C. | n=$\frac{2{M}_{2}-{M}_{1}}{58}$ | D. | n=$\frac{{M}_{2}-{M}_{1}}{58}$ |
分析 若此元素的最高正价为n,设金属为M,金属最高价氟化物为MFn,其相对分子质量为M1,其最高价的硫酸盐为M2(SO4)n,其相对分子质量为M2,结合化学式计算相对分子质量列式计算得到关系式.
解答 解:此元素的最高正价为n,设金属为M,金属最高价氟化物为MFn,其相对分子质量为M1,则M+19n=M1,①
其最高价的硫酸盐为M2(SO4)n,其相对分子质量为M2,则2M+96n=M2,②
②-①×2得到n=$\frac{{M}_{2}-2{M}_{1}}{58}$,
故选A.
点评 本题不仅考查了化学式的书写及意义,而且考查了相对分子质量的概念和常见元素(即氧元素的化合价)及其应用,更考查了有关化学式的计算等.它是综合性较强的题目,也是中考考查这块知识时的比较难一点的一道题.解答此类试题,首先要理清解题思路,然后大胆地设未知量,列式求解即可.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
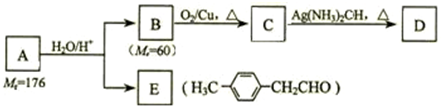
 .
. 、
、 、
、 (其中一种).
(其中一种).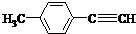 )的一条路线如下:
)的一条路线如下: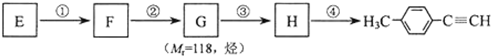
 ;
;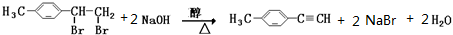 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2SiO3溶液中通入过量的CO2:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- | |
| B. | 常温下,铁和稀硝酸反应:2Fe+6HNO3═2Fe(NO3)3+3H2↑ | |
| C. | 碳酸氢钠和过量稀盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 铜和浓硫酸加热反应:Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$ Cu2++SO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
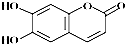
| A. | M的分子式为C9H8O4 | |
| B. | 1 mol M最多能与2 molBr2发生反应 | |
| C. | M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 | |
| D. | 1 mol M与足量NaHCO3反应能生成2 mol CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 |
| 容积/L | 1 | 1 | 2 |
| 反应物起始量 | 1molO3、2molO2 | ||
| 1molO3、2molNO2 | |||
| 1molO3、2molN2O5 | |||
| 温度/K | T1 | T2 | T2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;
;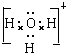 ;
;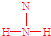 ;
;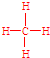 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com