
 NH4++OH-,溶液呈碱性,以此分析该题;
NH4++OH-,溶液呈碱性,以此分析该题; NH4++OH-,溶液呈碱性,则有c(OH-)>c(H+),由于NH3?H2O的电离程度较小,则c(Cl-)>c(OH-),则有:c(Na+)=c(Cl-)>c(OH-)>c(H+),即:[Na+]=[Cl-]>[OH-]>[H+]
NH4++OH-,溶液呈碱性,则有c(OH-)>c(H+),由于NH3?H2O的电离程度较小,则c(Cl-)>c(OH-),则有:c(Na+)=c(Cl-)>c(OH-)>c(H+),即:[Na+]=[Cl-]>[OH-]>[H+]

科目:高中化学 来源: 题型:
 某同学在研究前18号元素时发现,可以将它们排成如图所示的蜗牛形状,图中每个点代表-种元素,其中O点代表氢元素.下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的蜗牛形状,图中每个点代表-种元素,其中O点代表氢元素.下列说法中正确的是( )| A、离0点越远的元素原子半径越大 |
| B、虚线相连的元素处于同一族 |
| C、B、C最高价氧化物的水化物不能相互反应 |
| D、A、B组成的化合物中不可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ||||||||
| ② | ③ | ④ | ||||||
| ⑤ | ⑥ | ⑦ | ||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
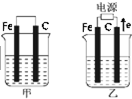 I.C2H6在氧气中完全燃烧生成二氧化碳和液态水,利用该反应设计一个燃料电池,用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入乙烷和氧气.通入乙烷气体的电极上发生的电极反应式是
I.C2H6在氧气中完全燃烧生成二氧化碳和液态水,利用该反应设计一个燃料电池,用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入乙烷和氧气.通入乙烷气体的电极上发生的电极反应式是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (Ⅰ)几种含硅元素的物质之间的相互转化关系如图所示.(注意:在溶液中观察到硅酸沉淀实际上是H4SiO4,H4SiO4在空气中易失水形成H2SiO3)试判断:
(Ⅰ)几种含硅元素的物质之间的相互转化关系如图所示.(注意:在溶液中观察到硅酸沉淀实际上是H4SiO4,H4SiO4在空气中易失水形成H2SiO3)试判断:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com