
| ���� | Na+ | Mg2+ | Cl- | SO42- |
| Ũ��/��g•L-1�� | 63.7 | 28.8 | 144.6 | 46.4 |


���� Ũ��ˮ�����Ȼ��ƣ�����������ƣ�һ�ﵽ�����Ŀ�ģ�������ʯ�ң�������������þ����������MgCl2•6H2O��һ����ˮ����MgCl2•2H2O����ͨ��HCl�ķ�Χ�м����Ȼ�þ��Һ�õ��Ȼ�þ�����ɵõ�þ��������
��1���ɱ�����������Ũ��ת�������ʵ���Ũ�����Ƚϣ���ѭ������Cl2��HCl��
��2��XΪ�Ȼ��ƣ�����������ƣ�
��3��������֪Mg��OH��Cl������������Mg��Ӧ������MgO��ͬʱ������������������
��4����������ݿ�֪1m3Ũ��ˮ����m��Mg2+��=1000L��28.8g/L��n��Mg2+��=$\frac{1000��28.8}{24}$mol��������Mg��OH��2�����ʵ���Ϊ$\frac{1000��28.8}{24}$mol��80%����������ˮ����MgCl2�����ʵ���Ϊ$\frac{1000��28.8}{24}$��80%��90%���ټ����������
��5������������ԭ��Ӧ��V2O5����ԭ����V2O4•Li2O��
��6����ͼ��֪��2LiBH4��s��+MgH2��s��=2LiH��s��+2B��s��+MgH2��s��+3H2��g����H=+200 kJ•mol-1��
2LiBH4��s��+MgH2��s��=2LiBH4��s��+Mg��s����+H2��g����H=+76 kJ•mol-1��
2LiBH4��s��+MgH2��s��=2LiH��s��+MgB2��s��+4H2��g����H=+183 kJ•mol-1��
2LiH��s��+MgB2��s��+4H2��g��=2LiH��s��+2B��s��+MgH2��s��+3H2��g����H=+��200-183��kJ•mol-1��
����MgB2��s��+H2��g��=2B��s��+MgH2��s����H=+17 kJ•mol-1��
���ø�˹���ɽ�-��-�ڵ��Ȼ�ѧ����ʽ��
��� �⣺Ũ��ˮ�����Ȼ��ƣ�����������ƣ�һ�ﵽ�����Ŀ�ģ�������ʯ�ң�������������þ����������MgCl2•6H2O��һ����ˮ����MgCl2•2H2O����ͨ��HCl�ķ�Χ�м����Ȼ�þ��Һ�õ��Ȼ�þ�����ɵõ�þ��������
��1���ɱ�������c��Na+��=$\frac{63.7g/L}{23g/mol}$=2.77mol/L��c��Mg2+��=$\frac{28.8g/L}{24g/mol}$=1.2mol/L��c��Cl-��=$\frac{144.6g/L}{35.5g/mol}$=4.07mol/L��c��SO42-��=$\frac{46.4g/L}{96g/mol}$=0.48mol/L����SO42-�����ʵ���Ũ����С��������������������������Ӧ�����Ȼ��⣬�Ȼ������������þ��Ӧ�Ʊ��Ȼ�þ�����ѭ������Cl2��HCl��
�ʴ�Ϊ��SO42-��Cl2��HCl��
��2��XΪ�Ȼ��ƣ�����������ƣ�һ�ﵽ�����Ŀ�ģ�
�ʴ�Ϊ��CaCl2��
��3��������֪Mg��OH��Cl������������Mg��Ӧ������MgO����Ӧ�Ļ�ѧ����ʽΪ2Mg��OH��Cl+Mg=MgCl2+2MgO+H2����
�ʴ�Ϊ��2Mg��OH��Cl+Mg=MgCl2+2MgO+H2����
��4����������ݿ�֪1m3Ũ��ˮ����m��Mg2+��=1000L��28.8g/L��n��Mg2+��=$\frac{1000��28.8}{24}$mol��������Mg��OH��2�����ʵ���Ϊ$\frac{1000��28.8}{24}$mol��80%����������ˮ����MgCl2�����ʵ���Ϊ$\frac{1000��28.8}{24}$��80%��90%������Ϊ$\frac{1000��28.8}{24}$mol��80%��90%��95g/mol=82080g��
�ʴ�Ϊ��82080��
��5������������ԭ��Ӧ��V2O5����ԭ����V2O4•Li2O���缫����ʽΪV2O5+2Li++2e-=V2O4•Li2O��
�ʴ�Ϊ��V2O5+2Li++2e-=V2O4•Li2O��
��6����ͼ��֪��2LiBH4��s��+MgH2��s��=2LiH��s��+2B��s��+MgH2��s��+3H2��g����H=+200 kJ•mol-1��
2LiBH4��s��+MgH2��s��=2LiBH4��s��+Mg��s����+H2��g����H=+76 kJ•mol-1��
2LiBH4��s��+MgH2��s��=2LiH��s��+MgB2��s��+4H2��g����H=+183 kJ•mol-1��
2LiH��s��+MgB2��s��+4H2��g��=2LiH��s��+2B��s��+MgH2��s��+3H2��g����H=+��200-183��kJ•mol-1��
����MgB2��s��+H2��g��=2B��s��+MgH2��s����H=+17 kJ•mol-1��
����-��-�ڵã�Mg��s��+2B��s���TMgB2��s����H=-��17+76��kJ•mol-1=-93kJ•mol-1��
�ʴ�Ϊ��-93kJ•mol-1��
���� ���⿼����������ᴿ���ۺ�Ӧ�ü���ˮ��Դ���õȣ�Ϊ��Ƶ���㣬�����漰�Ȼ�ѧ����ʽ����д����˹���ɵ�Ӧ�ã��绯ѧ֪ʶ���ۺ���ǿ��������������ѧ���ķ������������������Ӧ����ѧ֪ʶ��������


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
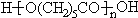 }����ȼ������˫��A���ϳ���·��ͼ��
}����ȼ������˫��A���ϳ���·��ͼ��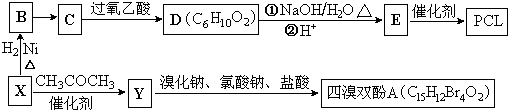
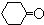
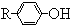 $\stackrel{�廯�ơ��Ȼ��ơ�����}{��}$
$\stackrel{�廯�ơ��Ȼ��ơ�����}{��}$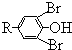
 ��
��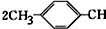 =CH2+2ROH+2CO+O2$\stackrel{һ������}{��}$
=CH2+2ROH+2CO+O2$\stackrel{һ������}{��}$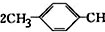 =CHCOOR+2H2O��������ϩΪ�л�ԭ�ϣ�����ͷ�Ӧ������ѡ���ϳɾۺ���Ϳ��
=CHCOOR+2H2O��������ϩΪ�л�ԭ�ϣ�����ͷ�Ӧ������ѡ���ϳɾۺ���Ϳ��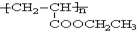 ��д���ϳɸ�Ϳ�ϵķ�Ӧ����ͼ��
��д���ϳɸ�Ϳ�ϵķ�Ӧ����ͼ��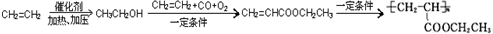 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���

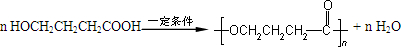 ��
��
 ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

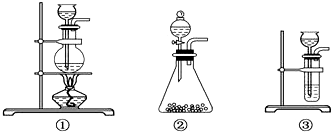
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ���ʽṹ�����ʰ���ԭ�ӡ����Ӻ;���ṹ�������������ݣ���ش��������⣺
���ʽṹ�����ʰ���ԭ�ӡ����Ӻ;���ṹ�������������ݣ���ش��������⣺ ���ڢ�A��Ԫ��ԭ����Χ�����Ų�ͨʽΪns2np5��
���ڢ�A��Ԫ��ԭ����Χ�����Ų�ͨʽΪns2np5��| H | B | C | N | O | F |
| 2.18 | 2.04 | 2.55 | 3.04 | 3.44 | 3.98 |
| Si | P | S | Cl | ||
| 1.90 | 2.19 | 2.58 | 3.16 |
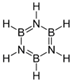 ���ܷ����ӳɷ�Ӧ��ȡ����Ӧ�����л���Ӧ���ͣ���
���ܷ����ӳɷ�Ӧ��ȡ����Ӧ�����л���Ӧ���ͣ���| �� | �������� | |
VSEPRģ �� | 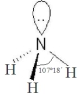 |  |
| �۵�/�� | -77.7 | -206.8 |
| �е�/�� | -33.5 | -129.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��2L�ܱ������ڣ�800��ʱ��Ӧ��2NO��g��+O2��g���T2NO2��g����ϵ�У�n��NO����ʱ��ı仯�����
��2L�ܱ������ڣ�800��ʱ��Ӧ��2NO��g��+O2��g���T2NO2��g����ϵ�У�n��NO����ʱ��ı仯�����| ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
| n��NO����mol�� | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
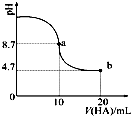 ��������10mL 0.1mol•L-1NaOH��Һ�м���0.1mol•L-1��һԪ��HA����ҺpH�ı仯������ͼ��ʾ������˵����ȷ���ǣ�������
��������10mL 0.1mol•L-1NaOH��Һ�м���0.1mol•L-1��һԪ��HA����ҺpH�ı仯������ͼ��ʾ������˵����ȷ���ǣ�������| A�� | a����ʾ��Һ��c��HA����c��A-�� | |
| B�� | ������HA��Һ10mlʱ��$\frac{{K}_{W}}{c��{H}^{+}��}$��1.0��10-7mol•L-1 | |
| C�� | a����ʾ��Һ��c��Na+��=c��A-��+c��HA�� | |
| D�� | b����ʾ��Һ��c��Na+����c��A-����c��H+����c��HA�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com