
【题目】羰基硫(O=C=S)广泛存在于以煤为原料制备的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染等。羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应式分别为:
①氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH1=+7 kJ·mol-1
H2S(g)+CO(g) ΔH1=+7 kJ·mol-1
②水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) ΔH2=-35 kJ·mol-1
H2S(g)+CO2(g) ΔH2=-35 kJ·mol-1
请回答下列问题:
(1)已知热化学方程式:CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH3,则ΔH3 =_______。
H2(g)+CO2(g) ΔH3,则ΔH3 =_______。
(2)水解反应达到平衡后,若减小容器的体积,则逆反应速率_______________(填“增大”、“减小”或“不变”,下同),COS的转化率_______________。
(3)COS氢解反应的平衡常数K与温度T具有如下的关系式![]() (a、b均为常数)
(a、b均为常数)
①如图能表示COS的氢解反应的直线为____________。
②一定条件下,催化剂Ⅰ和Ⅱ对COS氢解反应的催化作用如下:
达到平衡所需时间/min | a 的数值 | b的数值 | |
催化剂Ⅰ | t | a1 | b1 |
催化剂Ⅱ | 2t | a2 | b2 |

则a1_______________a2 (填“>”、“<”、“=”)。
(4)某温度下,维持体系体积恒定,物质的量分别为m、n的COS蒸气和H2发生氢解反应。已知COS的平衡转化率为α,则在该温度下反应的平衡常数K=________(用m、n、α等符号表示)。
【答案】
(1)-42 kJ/mol;(2)增大;不变;
(3)①z;② =;(4)![]() ;
;
【解析】
试题分析:(1)①COS(g)+H2(g)![]() H2S(g)+CO(g)△H1=+7KJmol-1,②COS(g)+H2O(g)
H2S(g)+CO(g)△H1=+7KJmol-1,②COS(g)+H2O(g)![]() H2S(g)+CO2(g)△H2 =-35KJ/mol,盖斯定律计算②-①得到:CO(g)+H2O(g)
H2S(g)+CO2(g)△H2 =-35KJ/mol,盖斯定律计算②-①得到:CO(g)+H2O(g)![]() H2(g)+CO2(g)△H3=-42KJ/mol,故答案为:-42 KJ/mol;
H2(g)+CO2(g)△H3=-42KJ/mol,故答案为:-42 KJ/mol;
(2)COS(g)+H2(g)H2S(g)+CO(g)反应前后气体体积不变,氢解反应平衡后减小容器的体积,压强增大,反应速率增大,平衡不动COS的转化率不变,故答案为:增大;不变;
(3)COS氢解反应的平衡常数K与温度T具有如下的关系式![]() ,式中a和b均为常数,随
,式中a和b均为常数,随![]() 增大,K增大。
增大,K增大。
①氢解反应为吸热反应,升高温度,k增大,如图中,表示COS氢解反应的直线为z,故答案为:z;
②K的数值只与温度有关,温度不变平衡常数不变与催化剂无关,![]() ,则a1=a2,故答案为:=;
,则a1=a2,故答案为:=;
(4) COS(g)+H2(g)![]() H2S(g)+CO(g)
H2S(g)+CO(g)
起始(mol) m n 0 0
反应 mα mα mα mα
平衡 m- mα n- mα mα mα
该温度下反应的平衡常数K=![]() =
=![]() ,故答案为:
,故答案为:![]() .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】合成尿素的反应2NH3(g)+CO2(g)=CO(NH2)2(尿素)+H2O(l) △H<0 分两步进行:①2NH3(g)+CO2(g)→NH4COONH2(s) △H1<0 ②NH4COONH2(s) →CO(NH2)2(尿素)+H2O(l) △H2>0。下列示意图中,能正确表示合成尿素过程中能量变化的是( )
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是一种重要的化工产品,易溶于水,遇酸易分解,Na2S2O3稀溶液与BaCl2溶液混合无沉淀生成。工业制备Na2S2O3的反应为: S(s)+Na2SO3(aq)![]() Na2S2O3(aq),产品中常含有少量Na2CO3 、 Na2SO3和Na2SO4。实验室拟用如下实验装置在C中制备Na2S2O3。
Na2S2O3(aq),产品中常含有少量Na2CO3 、 Na2SO3和Na2SO4。实验室拟用如下实验装置在C中制备Na2S2O3。

请回答下列问题:
(1)按如图所示装置进行实验,装置A中反应的化学方程式是______________________。装置C中可观察到溶液先变浑浊,后又澄清,生成的浑浊物质化学式为___________。
(2)装置B的作用为_________;为保证Na2S2O3的产量,实验中通入的SO2不能过量,原因是_________。
(3)为了验证固体硫代硫酸钠工业产品中含有碳酸钠,选用下列装置进行实验:

①实验装置的连接顺序依次________________(填装置的字母代号),装置C中的试剂为____________。
②能证明固体中含有碳酸钠的实验现象是__________________。
(4)若要检验固体硫代硫酸钠工业产品中含有Na2SO3,需先加水配成稀溶液,再依次加入的试剂为_____________________和品红溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质按酸、碱、盐、有机物、混合物顺序排列的是( )
A. 硝酸、苛性钠、明矾、淀粉、氯水
B. 碳酸钠、盐酸、食盐、酒精、合金
C. 醋酸、纯碱、碳酸钙、硝基苯、石油
D. 氢溴酸、消石灰、高锰酸钾、福尔马林、石油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、实验现象、解释或结论不正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 将蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近 | 产生大量白烟 | 氨气和氯化氢反应生成固体物质 |
B | 常温下,将洁净的铁皮放入浓硫酸或浓硝酸中 | 无明显现象 | 常温下,浓硫酸、浓硝酸与铁不反应 |
C | 在导管口点燃纯净的氢气,然后就导管伸入盛满氯气的集气瓶 | 产生苍白色火焰 | 物质燃烧不一定需要氧气 |
D | 加热试管中的氯化铵固体 | 试管底部的固体逐渐减少 | 氯化铵受热分解 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是各种不同密度的硝酸与铁反应(相同温度)时主要还原产物的分布图。请认真读图分析,回答有关问题。
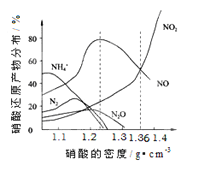
(1)下列叙述中正确的是(填序号)_______________。
A.图中横坐标是硝酸的密度,硝酸的密度越大,其浓度越小。
B.当还原剂和温度相同时,不同浓度的硝酸被还原的产物不是单一的,只是在某浓度时,以某种产物为主而已。
C.硝酸的浓度越大,还原产物中N元素低化合价产物越少
D.当硝酸密度大于1.3g·cm-3时,还原产物主要为NO、NO2
(2)从下图中选择仪器、药品验证由铁和过量1.36 g·cm-3硝酸反应产生的气体中含有NO(N2和O2的用量可自由控制,加热装置和固定装置省略)
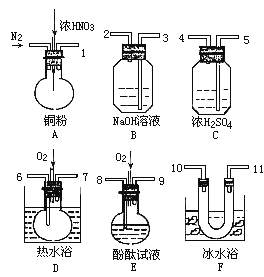
已知:Ⅰ.NO+NO2+2OH-=2NO2-+H2O
Ⅱ.常温下,NO2与N2O4混合存在,在0℃时几乎只有无色的N2O4液体或晶体存在。
①仪器的连接顺序(按左→右连接,填各接口的编号)为______________。
②反应前先通入N2,目的是___________________。
③确认气体中含的现象是__________________。
④装置F的作用是________________。
⑤若从A出来的混合气体中NO2、NO的体积分别为V1mL、V2mL(V1、V2均不为0),且本套装置最终能将氮的氧化物完全吸收,则装置中至少需要冲入氧气的体积为:________mL(相同状态下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com