
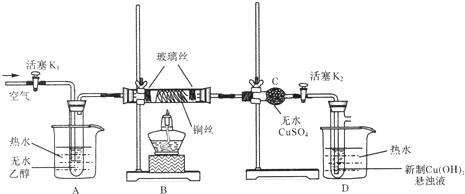
分析 本实验验证乙醇的催化氧化,B是发生该催化反应的装置,A是提供反应物乙醇和O2的装置,C、D是验证产物的装置.
(1)装置气密性检验的原理是:通过气体发生器与液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏;一般用到的方法有:空气热胀冷缩法、注水法、抽气或压气法等,据此进行分析解答即可;
(2)加热乙醇能够得到平稳的乙醇蒸汽;
(3)乙醇催化氧化过程中,铜先与氧气加热反应生成氧化铜,氧化铜再与乙醇反应生成乙醛和铜、水,移去酒精灯,继续不断缓缓地鼓入空气,B中仍重复如上现象,说明该反应为放热反应,放出的热量能够维持反应的进行;
(4)硫酸铜为白色固体,极易结合水生成蓝色的五水硫酸铜,通常用此检验水的存在;
(5)乙醛含有醛基能够与新制的氢氧化铜反应生成氧化亚铜、乙酸和水.
解答 解:(1)装置气密性检验的原理是:通过气体发生器与液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏,方法为:关闭活塞K2,打开K1,点燃B处酒精灯,A中液体压入长管中;停止加热冷却至室温,A中恢复原状(或关闭K1,打开K2,点燃B处酒精灯,D中长管口冒气泡;停止加热冷却至室温,D中液体倒吸入长管形成一段水柱),说明气密性良好;
故答案为:关闭活塞K2,打开K1,点燃B处酒精灯,A中液体压入长管中;停止加热冷却至室温,A中恢复原状(或关闭K1,打开K2,点燃B处酒精灯,D中长管口冒气泡;停止加热冷却至室温,D中液体倒吸入长管形成一段水柱),说明气密性良好;
(2)对A中的乙醇采用水浴加热的目的是为使A中乙醇较长时间地平稳地气化成乙醇蒸气;
故答案为:为使A中乙醇较长时间地平稳地气化成乙醇蒸气;
(3)乙醇催化氧化过程中,铜先与氧气加热反应生成氧化铜,氧化铜再与乙醇反应生成乙醛和铜、水,所以
实验时,点燃B处的酒精灯后,先预热直玻璃管,再集中火焰加热铜丝,看到的现象为:丝由红色变为黑色,很快又变为红色,反应方程式:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,移去酒精灯,继续不断缓缓地鼓入空气,B中仍重复如上现象,说明该反应为放热反应,放出的热量能够维持反应的进行;
故答案为:预热直玻璃管 铜丝由红色变为黑色,很快又变为红色,2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O 放热;
(4)硫酸铜为白色固体,极易结合水生成蓝色的五水硫酸铜,通常用此检验水的存在;
故答案为:检验乙醇氧化产生的H2O 白色粉末变为蓝色晶体;
(5)乙醛含有醛基能够与新制的氢氧化铜反应生成砖红色的氧化亚铜、乙酸和水,所以看到的现象为:产生砖红色沉淀;
故答案为:产生砖红色沉淀.
点评 本题考查了乙醇的催化氧化,明确乙醇的性质及催化氧化反应的原理是解题关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
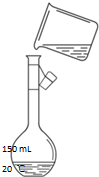 实验室用氯化钠固体配制1.00mol/L的NaCl溶液100mL,回答下列问题:
实验室用氯化钠固体配制1.00mol/L的NaCl溶液100mL,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
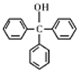 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示.
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示.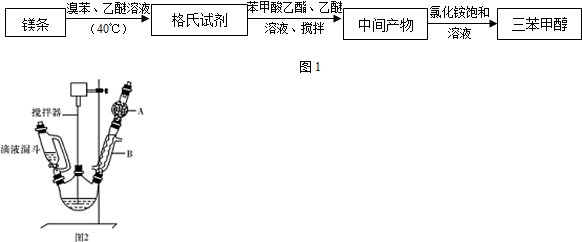
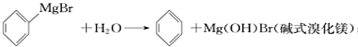
| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇、苯等有机溶剂 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、Na+、NO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$ | B. | Na+、Cl-、NH${\;}_{4}^{+}$、SO${\;}_{4}^{2-}$ | ||
| C. | K+、Cl-、HCO${\;}_{3}^{-}$、H+ | D. | Ca2+、Na+、Fe3+、NO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
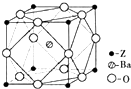 A、B、X、Y、Z为周期表前四周期元素,原子序数依次递增.已知:
A、B、X、Y、Z为周期表前四周期元素,原子序数依次递增.已知:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
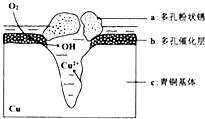 铜是一种重要的有色金属,近年来用途越来越广泛.请回答下列问题:
铜是一种重要的有色金属,近年来用途越来越广泛.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com