
【题目】双安妥明可用于降低血糖中的胆固醇.其结构简式为: 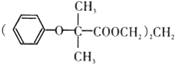
该物质的合成路线如图所示:
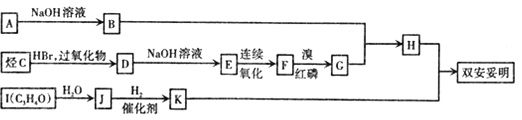
已知:I. 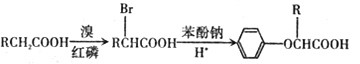
II.RCH=CH2![]() RCH2CH2Br
RCH2CH2Br
III.C的密度是同温同压下氢气密度的28 倍.且支链有一个甲基;I 能发生银镜反应且1 molI能与 2molH2 发生加成反应;K 的结构具有对称性。
请回答下列问题:
(1)A的结构简式为 ___________,J中所含官能团名称为_________。
(2)D的名称为__________ 。
(3)反应D→E的化学方程式为 ___________,其反应类型是__________。
(4)“H+K→双安妥明”的化学方程式为 ___________。
(5)L为比H的相对分子质量小14的同系物.其中满足①苯环上有两个取代基,② 苯环上一氯代物只有两种,③能与FeCl3溶液发生显色反应.且属于酯的L有_______种 。
【答案】![]() 羟基和醛基 2- 甲基- 1- 溴丙烷 (CH3) 2CHCH2Br+NaOH
羟基和醛基 2- 甲基- 1- 溴丙烷 (CH3) 2CHCH2Br+NaOH![]() (CH3)2CHCH2OH+NaBr 取代反应
(CH3)2CHCH2OH+NaBr 取代反应 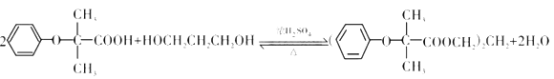 6
6
【解析】
由双安妥明的结构,合成双安妥明的物质为HOCH2CH2CH2OH、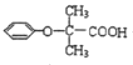 ,C的密度是同温同压下H2密度的28倍,C的相对分子质量为56,且支链有一个甲基,能发生加成反应,则C结构简式为C(CH3)2=CH2;I的分子式为C3H4O,经过系列反应生成K,根据碳原子数目可知,K为HOCH2CH2CH2OH,I能发生银镜反应,分子中含有-CHO,且1molI能与2mol氢气发生加成反应,说明分子中还含有C=C双键,故I为CH2=CH-CHO,J为HOCH2CH2CHO;H为
,C的密度是同温同压下H2密度的28倍,C的相对分子质量为56,且支链有一个甲基,能发生加成反应,则C结构简式为C(CH3)2=CH2;I的分子式为C3H4O,经过系列反应生成K,根据碳原子数目可知,K为HOCH2CH2CH2OH,I能发生银镜反应,分子中含有-CHO,且1molI能与2mol氢气发生加成反应,说明分子中还含有C=C双键,故I为CH2=CH-CHO,J为HOCH2CH2CHO;H为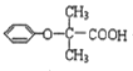 ,B与G反应生成
,B与G反应生成 ,由反应信息Ⅰ可知,合成H的物质为苯酚钠、BrC(CH3)2COOH,C的分子式为C4H8,经过系列转化生成G,根据碳原子数目可知,G为BrC(CH3)2COOH,故B为
,由反应信息Ⅰ可知,合成H的物质为苯酚钠、BrC(CH3)2COOH,C的分子式为C4H8,经过系列转化生成G,根据碳原子数目可知,G为BrC(CH3)2COOH,故B为![]() ,A与氢氧化钠反应生成B,故A为
,A与氢氧化钠反应生成B,故A为![]() ;
;
F在溴/红磷作用下生成G,根据反应信息Ⅰ,可知F为CH(CH3)2COOH,E连续氧化生成F,故E为CH(CH3)2CH2OH,D转化生成E,D为CH(CH3)2CH2Br;
(1)根据上述分析可得,A的结构简式![]() ,J为HOCH2CH2CHO,J中所含官能团名称为羟基和醛基,故答案为:
,J为HOCH2CH2CHO,J中所含官能团名称为羟基和醛基,故答案为:![]() ;羟基和醛基;
;羟基和醛基;
(2)D结构简式为为CH(CH3)2CH2Br,D的名称为2-甲基-1-溴丙烷,故答案为:2-甲基-1-溴丙烷;
(3)D为CH(CH3)2CH2Br,D发生水解反应生成E,反应D→E的化学方程式为(CH3)2CHCH2Br+NaOH![]() (CH3)2CHCH2OH+NaBr,反应类型是水解反应或取代反应,故答案为:(CH3)2CHCH2Br+NaOH
(CH3)2CHCH2OH+NaBr,反应类型是水解反应或取代反应,故答案为:(CH3)2CHCH2Br+NaOH![]() (CH3)2CHCH2OH+NaBr;取代反应;
(CH3)2CHCH2OH+NaBr;取代反应;
(4)H+K→双安妥明的反应方程式为: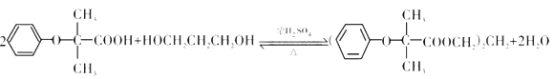
 ;
;
(5)H为 ,L为与比H分子量小14同系物的同分异构体,则L比H少一个-CH2原子团,苯环上有两个取代基,苯环上一氯代物只有两种,则苯环上只有两种氢原子,能和氯化铁显紫色,说明含有酚羟基,且属于酯,说明含有酯基,
,L为与比H分子量小14同系物的同分异构体,则L比H少一个-CH2原子团,苯环上有两个取代基,苯环上一氯代物只有两种,则苯环上只有两种氢原子,能和氯化铁显紫色,说明含有酚羟基,且属于酯,说明含有酯基,
如果取代基为—OH、—COOCH2CH3,处于对位,有1种,
如果取代基为—OH、—CH2COOCH3,处于对位,有1种;
如果取代基为—OH、HCOOCH2CH2—,处于对位,有1种;
如果取代基为—OH、HCOOCH(CH3)—,处于对位有1种;
如果取代基为—OH、CH3COOCH2—,处于对位有1种;
如果取代基为—OH、CH3CH2COO—,处于对位有1种,
所以符合条件的有6种,故答案为:6;


科目:高中化学 来源: 题型:
【题目】已知①---⑩号元素在周期表中的位置如图。试回答下列问题:

(1)上述元素中属于d区的有:________。
(2)②、③、④三种元素的第一电离能由大到小的顺序为_________(用元素符号表示)。
(3)⑧号元素在元素周期表中的位置是_______________,其原子核外未成对电子数为_______________,⑩号原子处于基态时核外电子排布式为___________,已知元素⑩和⑦的电负性分别为1.9和2.5,则⑩与⑦形成的化合物属于__________(填“离子”或“共价”)化合物。
(4)③号元素原子与①号元素原子形成的原子个数比为![]() 的分子X在①与④形成的化合物Y中的溶解度很大,其主要原因是____________。
的分子X在①与④形成的化合物Y中的溶解度很大,其主要原因是____________。
(5)④号和⑦号元素组成的原子个数比为3:1的-2价阴离子的空间构型、中心原子的杂化类型分别是:____________,____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铜易溶于水,在130'℃时会发生分解反应,是一种燃烧催化剂,以食盐等为原料制备高氯酸铜 [ Cu(ClO4)26 H2O) ]的一种工艺流程如下:
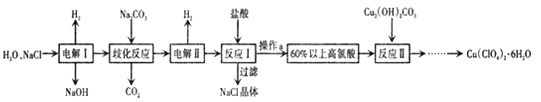
回答下列问题
(1)“电解I”的化学方程式为_________,所用交换膜是_(填“阳离子交换膜或“阴离子交换膜”) 。
(2)歧化反应是同一种物质中同种元素(自身氧化还原反应 ,已知上述工艺流程中“歧化反应”的产物之一为 NaClO3
①“歧化反应”的化学方程式为_。
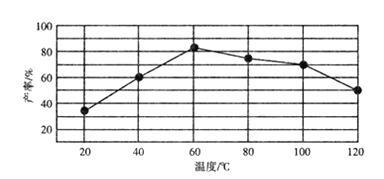
②“歧化反应”阶段不同温度对产率影响的结果如图所示。则该反应最适宜的温度是______。
(3)“电解II”的阳极产物为 ______(填离子符号).
(4) 该流程中可循环利用的物质是 _________(填化学式) 。
(5) 用该工艺流程制备高氯酸铜时,若起始时NaCl的质量为a千克。 最终制得的Cu( ClO4)2 6 H2O为b千克.则产率为_____(用含a、 b 的代数式表示) 。
(6) 某温度下 ,高氯酸铜可按A、B 两种方式同时分解.分解过程中铜的化合价不发生改变。A方式为Cu( ClO4)2![]() CuCl2+4O2↑按A、B两种方式分解的高氯酸铜的量相同时.转移的电子数之比为8:7 , 则B方式 为__________ (用化学方程式表示).
CuCl2+4O2↑按A、B两种方式分解的高氯酸铜的量相同时.转移的电子数之比为8:7 , 则B方式 为__________ (用化学方程式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在冶金工业中,常以C作为还原剂,如温度高于980 K时,氧化产物以CO为主,低于980 K时以CO2为主。
(1)已知2CO(g)![]() CO2(g)+C(s),T=980 K时ΔH-TΔS=0。当体系温度低于980 K时,估计ΔH-TΔS________0(选填“大于”、“小于”或“等于”);当体系温度高于980 K时,该反应________自发进行(填“能”或“不能”)。
CO2(g)+C(s),T=980 K时ΔH-TΔS=0。当体系温度低于980 K时,估计ΔH-TΔS________0(选填“大于”、“小于”或“等于”);当体系温度高于980 K时,该反应________自发进行(填“能”或“不能”)。
(2)电子工业中清洗硅片上的SiO2(s)的反应为:
SiO2(s)+4HF(g)===SiF4(g)+2H2O(g)
ΔH(298.15 K)=-94.0 kJ·mol-1
ΔS(298.15 K)=-75.8 J·mol-1·K-1。
设ΔH和ΔS不随温度变化而变化,则此反应自发进行的温度是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.3×101 | 1.7×105 | 6.2×1010 | K1=4.3×107 K2=5.6×1011 |
回答下列问题:
(1)写出碳酸的第一级电离平衡常数表达式:K1=_______________________。
(2)等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为________(填字母)。
(3)常温下,0.1 mol·L1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是________(填序号)
A.[H+] B.[H+]/[CH3COOH]
C.[H+]·[OH] D.[OH]/[H+]
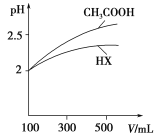
(4)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
(5)写出少量CO2通入次氯酸钠溶液中的离子方程式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应 :2NaClO2 + Cl2 ===2ClO2 + 2NaCl。
下图是实验室用于制备和收集一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。其中E中盛有CCl4液体(用于除去ClO2中的未反应的Cl2)。
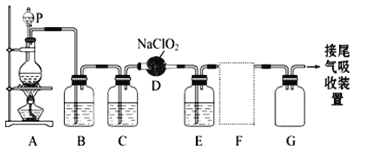
(1)仪器P的名称是_________________。
(2)写出装置A中烧瓶内发生反应的离子方程式:______________________________。
(3)B装置中所盛试剂是____________________。
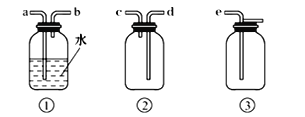
(4)F为ClO2收集装置,应选用的装置是___________(填序号),其中与E装置导管相连的导管口是__________(填接口字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCl2俗名称作光气,是有毒气体。在一定条件下,可发生的化学反应为:COCl2(g) ![]() CO(g)+Cl2(g) ΔH<0 下列有关说法不正确的是
CO(g)+Cl2(g) ΔH<0 下列有关说法不正确的是
A. 在一定条件下,使用催化剂能加快反应速率
B. 当反应达平衡时,恒温恒压条件下通入Ar,COCl2的转化率不变
C. 单位时间内生成CO和消耗Cl2的物质的量比为1∶1时,反应达到平衡状态
D. 平衡时,其他条件不变,升高温度可使该反应的平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg和Al的混合物投入500 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如下图所示。则下列说法正确的是( )

A.Mg和Al的总质量为8 g
B.原稀硫酸溶液的物质的量浓度为5 mol·L-1
C.生成的H2在标准状况下的体积为11.2 L
D.NaOH溶液的物质的量浓度为5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)![]() Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
A. 以X浓度变化表示的反应速率为0.001 mol·L-1·s-1
B. X和Y的转化率相等
C. 若增大压强,则物质Y的转化率减小
D. 若升高温度,X的体积分数增大,则该反应的ΔH>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com