
利用下列实验装置能完成相应实验的是( )
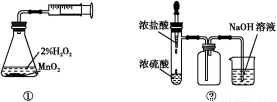
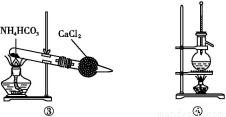
A.装置①测定化学反应速率
B.装置②制取并吸收HCl
C.装置③制备纯净的NH3
D.装置④可用于分离沸点相差较大的互溶液体混合物
科目:高中化学 来源:2014高考化学名师知识点精编 专题6原子结构化学键练习卷(解析版) 题型:选择题
下列叙述中正确的是( )
A.以共价键形成的单质中只存在非极性键,以共价键形成的化合物中只存在极性键
B.NaCl和SiC晶体熔化时,克服粒子间作用力的类型相同
C.PCl3和Na2O2中各原子或离子最外层都满足8电子稳定结构
D.24Mg34S晶体中电子总数与中子总数之比为1∶1
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题3离子反应练习卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式是( )
A.过氧化钠固体与水反应:2O22—+2H2O 4OH-+O2↑
4OH-+O2↑
B.向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42—恰好沉淀完全:2Al3++3SO42—+3Ba2++6OH- 2Al(OH)3↓+3BaSO4↓
2Al(OH)3↓+3BaSO4↓
C.向次氯酸钠溶液中通入少量SO2:ClO-+SO2+H2O Cl-+SO42—+2H+
Cl-+SO42—+2H+
D.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+ 4Fe3++2H2O
4Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题23实验方案的设计与评价练习卷(解析版) 题型:选择题
某化学兴趣小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案一:铜铝混合物 测定生成气体的体积
测定生成气体的体积
方案二:铜铝混合物 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是( )
A.溶液A和溶液B均可以是盐酸或NaOH溶液
B.若溶液B选用浓硝酸,测得铜的质量分数偏大
C.方案一可能产生氢气,方案二可能剩余铜
D.实验室中方案二更便于实施
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题22物质的检验、分离和提纯练习卷(解析版) 题型:实验题
aF是一种重要的氟盐,主要用作农作物杀虫剂、木材防腐剂等。某课题组设计了以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵的实验,其工艺流程如下:
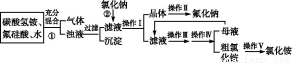
已知:20 ℃时氯化铵的溶解度为37.2 g,氟化钠的溶解度为4 g,Na2SiF6微溶于水。
(1)操作Ⅱ是洗涤、干燥,其目的是 ,
操作Ⅲ和操作Ⅳ的名称依次是 (填写序号)。
a.过滤 b.加热蒸发 c.冷却结晶 d.洗涤
(2)上述流程中①的化学反应方程式:
H2SiF6+ NH4HCO3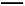 NH4F+ H2SiO3↓+ CO2↑+
NH4F+ H2SiO3↓+ CO2↑+
(3)流程①中NH4HCO3必须过量,其原因是 。
(4)若不考虑氟化钠的溶解,7.2 g氟硅酸理论上最多能生产 g氟化钠。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题21化学实验基础练习卷(解析版) 题型:实验题
某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1NaOH溶液
(1)若实验中大约要使用470 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从图中选择称量NaOH固体所需要的仪器是(填字母): 。
名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
Ⅱ.测定中和热
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、盐酸、NaOH溶液,尚缺少的实验玻璃用品是 。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | |||
H2SO4 | NaOH | 平均值 | ||||
1 | 26.2 | 26.0 | 26.1 | 30.1 |
|
|
2 | 27.0 | 27.4 | 27.2 | 33.3 |
| |
3 | 25.9 | 25.9 | 25.9 | 29.8 |
| |
4 | 26.4 | 26.2 | 26.3 | 30.4 |
| |
②近似认为0.50 mol·L-1NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=“4.18”J/(g·℃)。则中和热ΔH= (取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题21化学实验基础练习卷(解析版) 题型:选择题
下列实验操作正确的是( )
A.测定某浓度盐酸的pH时,先将pH试纸用蒸馏水湿润
B.容量瓶用蒸馏水洗净,必须烘干后才能用于溶液的配制
C.用苯萃取溴水中的溴之后进行分液时,水层从分液漏斗的下口放出
D.中和滴定时,锥形瓶需要用待测液润洗后才能使用
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题1物质的分类分散系练习卷(解析版) 题型:选择题
FeCl3溶液和Fe(OH)3胶体具有的共同性质是( )
A.滴入盐酸,先产生沉淀,然后沉淀又溶解
B.都能透过半透膜
C.都有丁达尔现象
D.加热蒸干灼烧,最终都有Fe2O3生成
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题16硫及其化合物练习卷(解析版) 题型:填空题
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2:4FeS2+11O2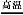 8SO2+2Fe2O3,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为 L。
8SO2+2Fe2O3,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为 L。
(2)实验室中用下列装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16.8 ℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)
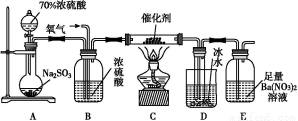
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是 。
②实验过程中,需要通入氧气。试写出一个用如图所示装置制取氧气的化学方程式 。
③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是 。
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是 (用含字母的代数式表示,不用化简)。
(3)某学习小组设计用如图装置验证二氧化硫的化学性质。
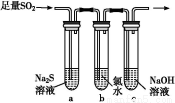
①能说明二氧化硫具有氧化性的实验现象为 。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是 (填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为 。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com