
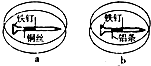
 如图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和
如图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和| A、a中铁钉发生还原反应 |
| B、b中铁钉附近呈现红色 |
| C、a中铜丝附近呈现蓝色 |
| D、b中铝条附近有气泡产生 |


科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
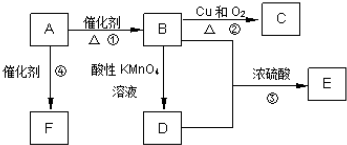
| A、使用催化剂和施加高压,都能提高反应速率,都对化学平衡状态无影响 |
| B、使用催化剂和施加高压,都能提高反应速率,只有压强对化学平衡状态有影响 |
| C、采用循环操作,能提高NH3的平衡浓度 |
| D、采用循环操作,能加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
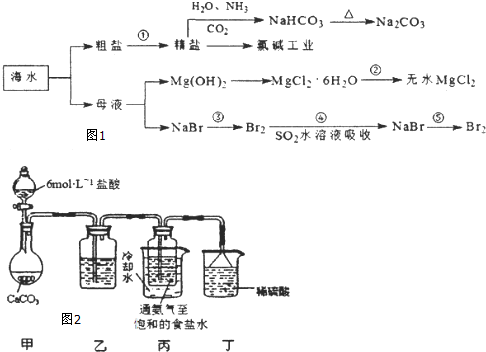
查看答案和解析>>
科目:高中化学 来源: 题型:
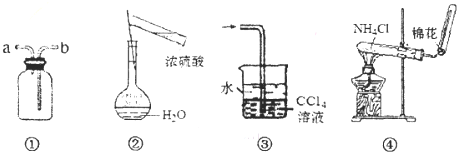
| A、装置①可用于排空气法收集NO气体 |
| B、可用图②所示装置及操作配制一定物质的量浓度的硫酸 |
| C、装置③可用于吸收氯化氢或氨气 |
| D、实验室可用装置④制取NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
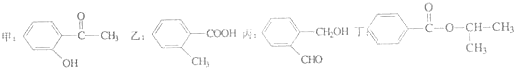
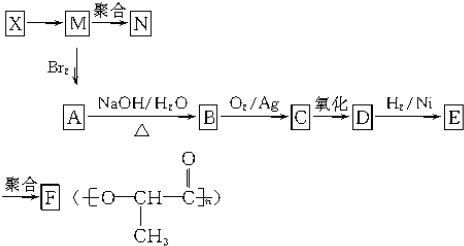
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com