
| A、2.4 | B、3 | C、11 | D、12 |
| 0.0005mol |
| 0.5L |
| 1×10-14 |
| 1×10-3 |


科目:高中化学 来源: 题型:
 上的碳原子分别称为伯碳、仲碳、叔碳、季碳原子,数目分别用n1、n2、n3、n4表示.例如:2,3,4,4-四甲基己烷.即:
上的碳原子分别称为伯碳、仲碳、叔碳、季碳原子,数目分别用n1、n2、n3、n4表示.例如:2,3,4,4-四甲基己烷.即: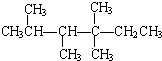 中n1=6,n2=1,n3=2,n4=1.根据不同烷烃的组成和结构,可分析出烷烃(除CH4外)中各原子数的关系.
中n1=6,n2=1,n3=2,n4=1.根据不同烷烃的组成和结构,可分析出烷烃(除CH4外)中各原子数的关系.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纳米材料是指一种称为“纳米”的新物质制成的材料 |
| B、绿色食品是指不含任何化学物质的食品 |
| C、生物固氮是指植物将空气中的氮气转变为氮的化合物 |
| D、光导纤维是以玻璃为主要原料制成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝粉投入氢氧化钠溶液中:2Al+2OH-═2AlO2-+H2↑ |
| B、氯化铝溶液中加入足量的氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
| C、氯化铁溶液中加入铁粉:Fe3++Fe═2Fe2+ |
| D、氯化亚铁溶液跟氯气反应:Fe2++Cl2═Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、选用有效的催化剂能增大正反应速率并提高SO2的转化率 | ||
| B、增大反应体系的压强,反应速率不一定增大 | ||
| C、该反应是放热反应,降低温度将缩短反应达到平衡的时间 | ||
D、在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠和冷水反应 Na+2H2O=Na++2OH-+H2↑ |
| B、金属铝溶于氢氧化钠溶液 Al+2OH-=AlO2-+H2↑ |
| C、金属铝溶于盐酸中 2Al+6H+=2Al3++3H2↑ |
| D、铁跟稀硫酸反应 2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.8mol |
| B、1.6mol |
| C、2mol |
| D、4mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com