
����Ŀ���������������������������Ҫԭ��֮һ���������������ж��ַ�����
��1�������ü������ԭ���������֪��
CH4(g)��4NO2(g)��4NO(g)��CO2(g)��2H2O(g) ��H����574kJ/mol
CH4(g)��4NO(g)��2N2(g)��CO2(g)��2H2O(g) ��H����1160kJ/mol
��CH4(g)��NO2(g)��ԭΪN2(g)���Ȼ�ѧ����ʽ�� ��
��2��NH3����ԭ����������SCR)������ĿǰӦ����㷺���������������ѳ������������Ļ�ѧ��Ӧ�ǣ�2NH3(g)��NO(g)��NO2(g)![]() 2N2(g)��3H2O(g)��H<0��Ϊ��ߵ��������ת���ʿɲ�ȡ�Ĵ�ʩ����һ�������� ��
2N2(g)��3H2O(g)��H<0��Ϊ��ߵ��������ת���ʿɲ�ȡ�Ĵ�ʩ����һ�������� ��
��3������β����������Ҫԭ��Ϊ��2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)����H��0
2CO2(g)+N2(g)����H��0
���÷�Ӧƽ�ⳣ������ʽ
�����÷�Ӧ���������������ܱ���ϵ�н��У�����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬���� ������ţ���

��4������ClO2�����������ﷴӦ�������£�![]()
��Ӧ���Ļ�ѧ����ʽ��2NO+ClO2+H2O===NO2+HNO3+2HCl����Ӧ���Ļ�ѧ����ʽ�ǡ�����11.2LN2���ɣ���״������������ClO2 g��
��5����ҵ�����к��е�NO2�����õ�ⷨ��������NO2Ϊԭ�Ͽ���������ɫ������N2O5���Ʊ�����֮һ���Ƚ�NO2ת��ΪN2O4Ȼ����õ�ⷨ�Ʊ�N2O5��װ������ͼ��ʾ��Pt��Ϊ�ĵ缫��Ӧʽ�� ��

���𰸡���1��CH4(g)��2NO2(g)��N2(g)��CO2(g)��2H2O(g)��H����867kJ/mol
��2������NH3Ũ�ȣ�������ѹǿ�������¶ȣ�
��3����![]() ��bd
��bd
��4��2NO2+4Na2SO3��N2+4Na2SO4��67.5
��5��N2O4+2HNO3��2e����2N2O5+2H+
��������
�����������1����֪����CH4(g)��4NO2(g)��4NO(g)��CO2(g)��2H2O(g)��H����574kJ/mol
��CH4(g)��4NO(g)��2N2(g)��CO2(g)��2H2O(g)��H����1160kJ/mol
�������˹���ɿ�֪����+����/2���õ�CH4(g)��NO2(g)��ԭΪN2(g)���Ȼ�ѧ����ʽ��CH4(g)��2NO2(g)��N2(g)��CO2(g)��2H2O(g)��H����867kJ/mol��
��2����ѧ��Ӧ��2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O����������������������Ӧ�����NOx��ת������ƽ�������ƶ����������ȡ�Ĵ�ʩ������NH3Ũ����������ѹǿ�������¶�����
2N2(g)+3H2O����������������������Ӧ�����NOx��ת������ƽ�������ƶ����������ȡ�Ĵ�ʩ������NH3Ũ����������ѹǿ�������¶�����
��3������ѧƽ�ⳣ������һ�������£������淴Ӧ�ﵽƽ��״̬ʱ��������Ũ�ȵ���֮���ͷ�Ӧ��Ũ�ȵ���֮���ı�ֵ�����ݷ���ʽ��֪�÷�Ӧƽ�ⳣ������ʽ![]() ��
��
��a��t1ʱ����Ӧ������Ȼ�ڱ仯��˵��û�дﵽƽ��״̬��a����B��t1ʱƽ�ⳣ�����ٱ仯�����淴Ӧ������ȣ�˵���ﵽ��ƽ��״̬��b��ȷ��C��t1ʱ������̼��һ�����������ʵ������ڱ仯��˵�����淴Ӧ���ʲ���ȣ���Ӧû�дﵽƽ��״̬��c����D��t1ʱһ�������������������ٱ仯���������淴Ӧ������ȣ��ﵽ��ƽ��״̬��d��ȷ����ѡbd��
��3����Ӧ�����������Ʊ�����Ϊ�����ƣ�ͬʱ������������Ӧ�Ļ�ѧ����ʽ��2NO2+4Na2SO3��N2+4Na2SO4��������Ӧ�ķ���ʽ��֪ת����ϵʽ�У�2ClO2��2NO2��N2��n(ClO2)=2n(NO2)=1mol��m(ClO2)=67.5g��
��5��Pt�缫�Ҳ���N2O4��˵����������õ����ӣ���������������Pt�缫����������N2O4ʧȥ����ת��ΪN2O5���缫��ӦʽΪN2O4+2HNO3��2e����2N2O5+2H+��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ���������������A��B��C��D��E����Ԫ�أ�����A�Ļ�̬ԭ����3����ͬ���ܼ������ܼ��еĵ�������ȣ�C�Ļ�̬ԭ��2p�ܼ��ϵ�δ�ɶԵ�������Aԭ�ӵ���ͬ��DΪ��������ԭ�Ӱ뾶��������Ԫ�أ�E��ԭ������Ϊ22��
(1)��E����Ϊ�������������������������������Ҫ�Ľṹ���ϡ�Eԭ�ӻ�̬����Χ��������Ų�ʽΪ ��
�����ʯ(EO2)���۵�1825���������η�ֱ�ӵ����ʯ�ɻ�ý���E�����ʯ�����ľ��������� ���壻
��ECl4����NH4Cl��Ӧ���������(NH4)2[ECl6]����������У��γ���λ��ʱ�ṩ�¶Ե��ӵ��� (��Ԫ�ط���)����NH4����Ϊ�ȵ������һ��������Ϊ (�ѧʽ)��������ԭ���ӻ�����Ϊ �ӻ���
(2)��A��B��C����Ԫ���У��縺����С�����˳���� (��Ԫ�ط��Żش�)��
(3)Ԫ��A�ļ���̬�⻯��ķе� (�����ڡ�,�����ڡ�)Ԫ��B�ļ���̬�⻯��ķе㣬����Ҫԭ���� ��
(4)��B�γɵ�����B3����AC2��Ϊ�ȵ����壬��B3����
���ӹ���Ϊ ��
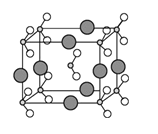
(5)��B��C��D����Ԫ���γɵĻ����ᄃ��ľ�����ͼ��ʾ����û�����Ļ�ѧʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в���Ԫ�ص����ʡ���;��ԭ��(�����)�ṹ�����ʾ��
Ԫ�ر�� | Ԫ��������ԭ��(�����)�ṹ |
W | ���ڱ���ԭ�Ӱ뾶��С��Ԫ�� |
X | �⻯�����������������ˮ���ﷴӦ������ |
Y | һ�ֺ����ڿ���ʱ����������һЩ�������� |
Z | M���K����1������ |
T | ��������ͬ�������壬����һ�ֿ����������� |
��1��Ԫ��Y�����ڱ��е�λ�õ�____��Ԫ��T�ļ����ӽṹʾ��ͼ_____��
��2��W��X��Z��T��������Ԫ�����γɼ������Ӽ����зǼ��Թ��ۼ��Ļ����д���û�����ĵ���ʽ____________��
��3��Ԫ��W��Ԫ��X��T���Էֱ��γɶ��ֺ����������Ϊ10���������������������Է�����Ӧ���� + �� ![]() �� + �����÷�ӦΪ��_____________��
�� + �����÷�ӦΪ��_____________��
��4��Ԫ��X��Ԫ��W��ԭ�Ӹ�����1��2�����γɳ����ڻ��ȼ�ϵĻ������죬Ԫ��T��Ԫ��W��ԭ�Ӹ�����Ϊ1��1�����γɻ����Z�����뼺�ܷ���������ԭ��Ӧ������X���ʺ���һ��Һ�廯���д���÷�Ӧ�Ļ�ѧ����ʽ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ��ͨ�����CO2���壬����û�г������ǣ� ��
A.Na2SiO3��Һ
B.Ca��OH��2��Һ
C.����Na2CO3��Һ
D.NaAlO2��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������������ԭ������ͬ����
A��2 L CO��2 L O2
B��ͬ��ͬѹ����2LO2��N2��NO�Ļ������2L
C��0.2 mol H2��4.48 L HCl
D����״����2 mol CO2��44.8 Lˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1��6-�����ᣨG���Ǻϳ���������Ҫԭ��֮һ����������̼ԭ�ӵĻ����������Ʊ�����ͼΪAͨ��������Ӧ�Ʊ�G�ķ�Ӧ���̣����ܵķ�Ӧ�м�����ΪB��C��D��E��F�����ش����⣺

��1��������A�к�̼87.8%������Ϊ�⣬A�Ļ�ѧ����Ϊ__________________��
��2��B��C�ķ�Ӧ����Ϊ_______________��
��3��F�Ľṹ��ʽΪ___________________��
��4���������м������У��˴Ź��������з�������______�����ٵ���__________����������,�����ж�ѡ����
��5����G�ϳ������Ļ�ѧ����ʽΪ______________________��
��6����Aͨ�������Ʊ�1��3��������ϩ�ĺϳ���·Ϊ______________����ʽ��A�������Լ�Bһ������ C����
��7���л���C��ͬ���칹�������������_________�֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ʵ����X+Y2+=X2++Y����Z+2H2O����ˮ��=Z(OH)2+H2������Z2+�������Ա�X2+��������Y��W���缫��ɵ�ԭ��أ��缫��ӦΪW2++2e�� = W��Y��2e��=Y2+����֪X��Y��W��Z�Ļ�ԭ����ǿ������˳����
A. X��Z��Y��W B. Z��W��X��Y C. Z��X��Y��W D. Z��Y��X��W
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ǧ����Ϊ��Դ��ʯīΪ�缫���CuSO4��Һ��װ����ͼ����һ��ʱ���Y�缫����6.4 g��ɫ����������ֹͣ��⡣����˵����ȷ���� ��������

A. aΪǦ���صĸ��� B. ��������SO42�����Ҳ��ƶ�
C. ������ʱ�������Һ��������8g D. Ǧ���ع���ʱ�����缫��ӦʽΪ��PbSO4+2e����Pb+SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͬ�����£�������(����������С�൱)�����н���������1 mol��L��1�����ᷴӦʱ������������
A. þ B. �� C. �� D. ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com