
【题目】在一定条件下![]() 与
与![]() 发生反应:
发生反应:![]() ,则下列关于元素M的叙述正确的是
,则下列关于元素M的叙述正确的是
A.M位于元素周期表中第VA族
B.M的氢化物的水溶液显酸性
C.![]() 中M元素只能被还原
中M元素只能被还原
D.![]() 在常温常压下一定是气体
在常温常压下一定是气体
【答案】B
【解析】
由反应方程式可知,M的最低负价为-1,则其最高正价为+7价,族序数等于最高正化合价;则M为卤族元素但F元素除外,处于中间价态的元素具有氧化性和还原性,常温常压下,氯气是气体、溴是液体、碘是固体,据此分析解答。
A.由上述分析可知,M位于元素周期表中VIIA族,故A错误;
B.F元素没有正化合价,所以M不能为F元素,可以为Cl、Br、I等,其氢化物HX水溶液均显酸性,故B正确;
C.M的最低负价为1,M最高正价为+7价,![]() 中M为+5价,处于中间价态,既具有氧化性又具有还原性,故C错误;
中M为+5价,处于中间价态,既具有氧化性又具有还原性,故C错误;
D.若M为Cl,单质为气体,若M为I或Br也可以发生如上反应,碘为固体,溴为液体,故D错误;
故答案为:B。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】1934年,居里夫妇![]() 粒子(4He)轰击27Al得到一种自然界中不存在的磷元素的一种核素(
粒子(4He)轰击27Al得到一种自然界中不存在的磷元素的一种核素(![]() ):
):![]() +
+![]()
![]()
![]() +
+![]() ,开创了人造核素的先河。
,开创了人造核素的先河。
(1)下列有关说法正确的有______(填序号)。
A. ![]() 的质子数是27 B.
的质子数是27 B. ![]() 是一种电中性粒子
是一种电中性粒子
C. ![]() 和
和![]() 互为同位素 D. P元素的相对原子质量为30
互为同位素 D. P元素的相对原子质量为30
(2)元素的化学性质主要取决于______(填序号)。
A. 原子最外层电子数 B. 原子核内中子数
C. 原子核内质子数 D. 原子质量数
(3)不同种元素的本质区别是______(填序号)。
A. 原子的质子数不同 B. 原子的中子教不同
C. 原子的最外层电子数不同 D. 原子的质量数不同
查看答案和解析>>
科目:高中化学 来源: 题型:
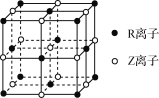
【题目】原子序数小于36的X、Y、Z、W、R五种元素,原子序数依次增大。五种元素中,仅R为金属元素,其原子序数为27。X价电子排布式为nsnnpn,元素Z基态原子s电子总数与p电子总数相等,W与其它四种元素能层数不同,且未成对电子数目为1个。根据判断出的元素回答下列问题:
(1)R2+离子核外电子排布式为________,X、Y、Z三种原子第一电离能由小到大的顺序为________(用具体元素符号表示)。
(2)1 mol配合物[R(XY)6]4-中含有σ键的数目为________。
(3)XZW2是一种高毒类物质,结构与甲醛(HCHO)相似,其沸点高于甲醛的主要原因是________。
(4)YW3为黄色、油状、具有刺激性气味的液体,该分子的立体构型为________(用文字描述)。
(5)某晶体的晶胞结构如图所示,则该化合物的化学式为________(R、Z用具体元素符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列填空:
(1)有下列分子或离子:①CS2,②PCl3,③H2S,④CH2O,⑤H3O+,⑥NH4+,⑦BF3,⑧SO2。粒子的立体构型为直线形的有________(填序号,下同);粒子的立体构型为V形的有________;粒子的立体构型为平面三角形的有________;粒子的立体构型为三角锥形的有____;粒子的立体构型为正四面体形的有____。
(2)俗称光气的氯代甲酰氯分子(COCl2)为平面三角形,但C—Cl键与C=O键之间的夹角为124.3°;C—Cl键与C—Cl键之间的夹角为111.4°,解释其原因:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中时刻存在着氮的转化。实现氮按照一定方向转化一直是科学领域研究的重要课题,如图为N2分子在催化剂的作用下发生的一系列转化示意图:
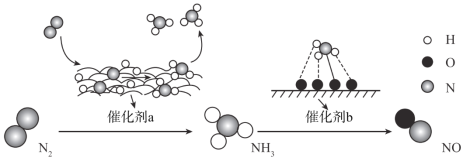
下列叙述正确的是
A.N2![]() NH3,NH3
NH3,NH3![]() NO均属于氮的固定
NO均属于氮的固定
B.催化剂a作用下氮原子发生了氧化反应
C.催化剂a、b表面均发生了极性共价键的断裂
D.使用催化剂a、b均可以提高单位时间内生成物的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一些净水器推销商在推销其产品时,进行所谓的“电解水法”实验,将纯净水与自来水进行对比。当电解装置插入纯净水和自来水中通电数分钟后,纯净水颜色无变化或略显黄色,而自来水却冒出气泡并生成灰绿色或红棕色的沉淀。根据上述现象,下列选项说法正确的是( )
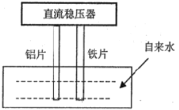
A.通电时,铝片做阳极,铁片做阴极
B.生成的气泡、红棕色或灰绿色的沉淀都是电解的直接或间接产物
C.通过对比,确实能说明自来水中含有大量对人体有毒有害的物质
D.铁片的电极反应:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀含铬废水的处理方法较多。
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强。为回收利用,通常采用如下流程处理:
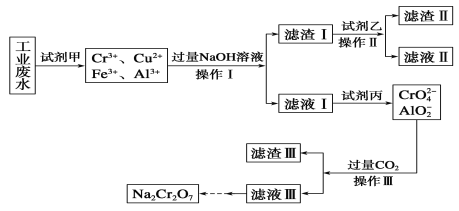
已知:a.Cr(OH)3→NaCrO2→Na2CrO4→Na2Cr2O7
b.Cu(OH)2能溶于氨水:Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O
请回答:
(1)操作Ⅰ的名称为__,上述操作Ⅰ、Ⅱ、Ⅲ相同,进行该实验操作所需要的主要玻璃仪器除烧杯、漏斗外,还有__。
(2)试剂乙的名称为__,滤渣Ⅱ的主要成分为__(写化学式)。
Ⅱ.工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,工业上常用还原沉淀法进行处理。
该处理方法的工艺流程为:CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若该平衡处于强酸性环境中,则溶液显___色。
(2)能说明第①步反应达平衡状态的是___。
A.Cr2O72-和CrO42-的浓度相同
B.2v(Cr2O72-)=v(CrO42-)
C.溶液的颜色不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:
Fe2O3(s)+3C(s)=2Fe(s)+3CO(g) ΔH1=+489.0kJmol-1,
C(s)+CO2(g)=2CO(g) △H2=+172.5kJmol-1
则CO还原Fe2O3(s)的热化学方程式为____________________。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:__________________。
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1。
CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1。
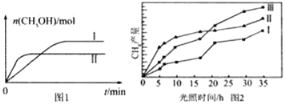
①线Ⅰ、Ⅱ对应的平衡常数大小关系为KI______KⅡ(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、b mol H2、 c mol CH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为____________。
(4)利用光能和光催化剂,可将CO2和H2(g)转化为CH4和O2,紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化见图2。在0~15小时内,CH4的平均生成速率I、Ⅱ和Ⅲ从大到小的顺序为_____________(填序号)
(5)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。
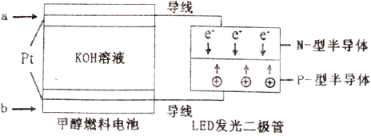
请写出加入(通入)b物质一极的电极反应式________________;每消耗6.4g甲醇转移的电子数为_______________。
(6)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将amol/L的醋酸与bmol/LBa(OH)2溶液等体积混合后,溶液中:2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。
某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
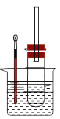
实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH溶液和5 mL 溴乙烷,振荡。
实验操作II:将试管如图固定后,水浴加热。
(1)用水浴加热而不直接用酒精灯加热的原因是_______________________________。
(2)观察到_________________________现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)鉴定生成物中乙醇的结构,可用的波谱是_________________________________。
(4)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是______________________,检验的方法是_____________(需说明:所用的试剂、简单的实验操作及预测产生的实验现象)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com