
| A、只含Na2CO3 |
| B、只含NaHCO3 |
| C、NaOH和Na2CO3的混合物 |
| D、Na2CO3和NaHCO3的混合物 |


科目:高中化学 来源: 题型:
| A、1mol铜片与含2mol H2SO4的浓硫酸共热 |
| B、1mol MnO2粉末与含2mol H2O2的溶液共热 |
| C、1mol MnO2粉末与含4mol HCl的稀溶液共热 |
| D、常温下1mol铜片投入含4mol HNO3的浓硝酸中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
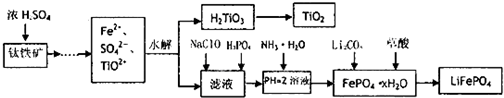
查看答案和解析>>
科目:高中化学 来源: 题型:
 过渡金属元素及其化合物的应用研究是目前科学研究的前沿之一.试回答下列问题:
过渡金属元素及其化合物的应用研究是目前科学研究的前沿之一.试回答下列问题:| 电离能/kJ?mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
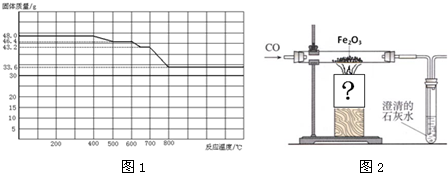
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | a的取值范围 | 产物的化学式或(离子符号) | ||||
| A | I2,Br- | |||||
| B |
| |||||
| C | ||||||
| D | I2,IO3-,Br2 | |||||
| E |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使用硫酸过量 |
| B、使用铁屑过量 |
| C、使用稀硫酸 |
| D、使用浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子化合物 | 电荷数 Z |
键长 pm |
晶格能 kJ?mol-1 |
熔点 °C |
莫氏硬度 |
| NaF | 1 | 231 | 923 | 993 | 3.2 |
| NaCl | 1 | 282 | 786 | 801 | 2.5 |
| MgO | 2 | 210 | 3791 | 2852 | 6.5 |
| CaO | 2 | 240 | 3401 | 2614 | 4.5 |
| A、晶格能的大小与正负离子电荷数和距离成正比 |
| B、晶格能越大,即正负离子间的静电引力越强,晶体的熔点就越高,硬度越大 |
| C、NaF晶体比NaCl晶体稳定 |
| D、表中物质CaO的晶体最稳定 |
| E、表中物质CaO的晶体最稳定 |
| F、表中物质CaO的晶体最稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液 | B、乳浊液 |
| C、悬浊液 | D、胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com