
| 11 |
| 2 |


科目:高中化学 来源: 题型:
| 一溴代二甲苯 | 234℃ | 206℃ | 218℃ | 204℃ | 205℃ | 214℃ |
| 对应的二甲苯 | 13℃ | -54℃ | -27℃ | -54℃ | -54℃ | -27℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 分子式 | C9H8O |
| 部分性质 | 能使Br2/CCl4褪色 |
| 分子式 | C16H14O2 |
| 部分性质 | 能使Br2/CCl4褪色 |
| 能在稀硫酸中水解 |
| 一定条件 |
| Ⅰ |

| O2/Cu |
| △ |
| 一定条件 |
| Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 用 品 | 溶 液 温 度 | 中和热 △H | |||
| t1 | t2 | ||||
| ① | 50mL 0.55mol?L-1NaOH |
50mL 0.5mol?L-1HCl |
20℃ | 23.3℃ | |
| ② | 50mL 0.55mol?L-1NaOH |
50mL 0.5mol?L-1HCl |
20℃ | 23.5℃ | |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
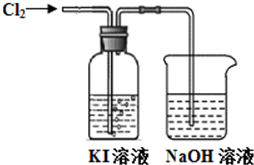 某同学对Cl2与KI溶液的反应进行了实验探究.反应装置如下:
某同学对Cl2与KI溶液的反应进行了实验探究.反应装置如下:| 操作 | 实验现象 | |
| a | 取2~3mL黄色溶液,加入足量CCl4,振荡静置. | CCl4层呈紫红色,水层显浅黄色. |
| b | 取2~3mL饱和碘水,加入足量CCl4,振荡静置. | CCl4层呈紫红色,水层几近无色. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com