
| 催化剂 |
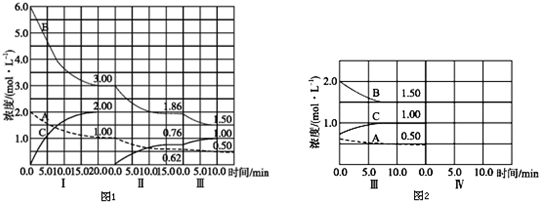
| 1mol/L |
| 20min |
| 1mol/L-0.62mol/L |
| 15min |
| 0.62mol/L-0.5mol/L |
| 10min |
| 3mol/L |
| 6mol/L |
| 3mol/L-1.86mol/L |
| 3mol/L |
| 1.86mol/L-1.5mol/L |
| 1.86mol/L |
 ;
; ;
;


科目:高中化学 来源: 题型:
| A、使用催化剂能加快反应速率 |
| B、改变压强对反应速率没有影响 |
| C、冬天气温低,反应速率降低,对人体危害更大 |
| D、无论外界条件怎样改变,均对此化学反应的速率无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下列各组物质不能按如图所示(表示反应一步完成)关系转化的是( )
下列各组物质不能按如图所示(表示反应一步完成)关系转化的是( )| 选项 | a | b | c |
| A | SiO2 | Na2SiO3 | H2SiO3 |
| B | Fe2O3 | FeCl3 | Fe(OH)3 |
| C | Al | Al(OH)3 | Al2O3 |
| D | NaHCO3 | Na2CO3 | NaOH |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0L1.0 mol?L-1的Na[Al(OH)4]水溶液中含有的氧原子数为2NA |
| B、常温常压下,8gO2含有4nA个电子 |
| C、标准状况下,22.4L盐酸含有nA个HCl分子 |
| D、1molNa被完全氧化生成Na2O2,失去2nA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 | HA物质的量 浓度(mol?L-1) | NaOH物质的量 浓度(mol?L-1) | 混合溶 液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学研究性学习小组探究Fe3+和SO32-之间发生的反应.
某化学研究性学习小组探究Fe3+和SO32-之间发生的反应.| 操作 | 现象及结论 |
| 基于方案一: | |
| 基于方案二: |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | ||
| D | 吸收未反应的CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电池放电时,负极周围溶液的pH不断减小 |
| B、电池放电时总反应是Cd+2NiO(OH)+2H2O=Cd(OH)2+2Ni(OH)2 |
| C、电池充电时,镉(Cd)元素被氧化 |
| D、电池充电时,电池的正极和电源的正极相连接 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com