
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.标准状况下,22.4 LCCl4含有的分子数为NA
B.标准状况下,aL氧气和氮气的混合气体含有的分子数约为![]()
C.46g NO2和N2O4的混合气体中含有的原子数为6NA
D.56gFe与足量的盐酸反应,转移的电子数为3NA
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2·12H2O(铵明矾)可用作泡沫灭火器的内留剂、石油脱色剂等。某兴趣小组同学用氧化铁、铝粉、镁条和氯酸钾等物质做铝热反应的铝灰及硫酸铵等为原料制备铵明矾的实验,步骤如下:
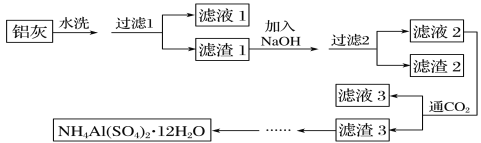
(1)下列有关说法中正确的是__(填字母)。
A.“滤液1”中含有K+、Mg2+、Cl-
B.“滤渣1”和“滤渣2”中含有相同的物质
C.“滤渣2”中含有氢氧化铁,氢氧化镁等固体
D.将“滤液3”蒸干并灼烧,可得纯碱
(2)用NaOH溶解“滤渣1”时,可以采用__方式提高浸出率。
(3)用NaOH溶解“滤渣1”时,可能发生的反应的化学方程式为①__、②_____。
(4)向“滤液2”中通入足量的CO2,写出相应的离子反应方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是亚硝酸根离子与钠离子组成的工业盐,具有咸味,其水溶液呈碱性.亚硝酸钠有毒,含有工业盐的食品对人体危害很大,有致癌性.加热到320℃以上则分解,生成氧气,氮气和氧化钠,能与AgNO3溶液反应生成难溶于水、易溶于酸的AgNO2.
(1)人体正常的血红蛋白含有Fe2+.若误食NaNO2,则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是___________________________(填序号).
A.亚硝酸盐被还原 B.维生素C是氧化剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是氧化剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是_________________(填序号).
A.测定这两种溶液的pH B.用筷子蘸取固体品尝味道
C.加强热收集气体检验 D.用HNO3酸化的AgNO3鉴别
(3)亚硝酸钠受热分解的化学反应方程式为:4NaNO2![]() 2N2↑+3O2↑+2Na2O
2N2↑+3O2↑+2Na2O
①从氧化还原反应角度分析,该反应说明NaNO2具有_____________________.(填氧化性、还原性或者既有氧化性又有还原性)
②该反应中的还原产物为______________________(写名称)
③若反应中转移3mol电子,得到Na2O的质量为________________g.
(4)己知Cl2具有强氧化性,能将溶液中的NO2﹣氧化为NO3﹣同时生成盐酸,请写出NaNO2溶液中通入Cl2的离子反应方程式____________________________________________________________________________.
(5)某工厂废液中,含2%~5%的NaNO2,直接排放会造成污染,NH2Cl能使NaNO2转化为不引起二次污染的N2,反应的化学方程式为______________________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z在周期表中位置关系如图所示
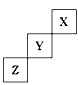
(1)X元素的名称是___________。
(2)Y在元素周期表中的位置是__________,它形成单质的化学式是_________。
(3)Z元素的原子结构示意图为__________。写出Z单质与铁反应的化学反应方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用酚酞作指示剂,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1的 CH3COOH溶液和HCN溶液所得滴定曲线如图。
(已知:CH3COOH、 HCN的电离平衡常数分别为1.75×10-5、6.4×10-10)

(1)图__(a或b)是NaOH溶液滴定HCN溶液的pH变化的曲线,判断的理由是__。
(2)点③所示溶液中所含离子浓度的从大到小的顺序:__。
(3)点①和点② 所示溶液中:c(CH3COO-)-c(CN-)__c(HCN)-c(CH3COOH)(填“>、<或=”)
(4)点②③④所示的溶液中水的电离程度由大到小的顺序是:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能量是人类生存基础,因此化学反应与能量关系一直是研究热点,贯穿于生活和生产各个领域 .
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为_______
(2)化学反应中放出的热能(焓变),△H与反应物和生成物的键能E有关。
已知:H2(g)+Cl2(g)=2HCl(g) △H=-185kJ/mol, E(H-H)=436kJ/mol,E(Cl-Cl)=243kJ/mol。
则E(H-Cl)=___________
(3)纳米级Cu2O由于具有优良的催化性能而受到关注,已知:
2Cu(s)+![]() O2(g)=CuO(s) △H=-169kJ.mol-1.
O2(g)=CuO(s) △H=-169kJ.mol-1.
C(s)+![]() O2(g)=CO(g) △H=-110.5kJ.mol-1
O2(g)=CO(g) △H=-110.5kJ.mol-1
2Cu(s)+O2(g)=2CuO(s) △H=-314kJ.mol-1
则工业上用炭粉在高温条件下还原CuO制取Cu和CO的热化学方程__________
(4)如图是N2和H2反应生成2molNH3过程中能量变化示意图
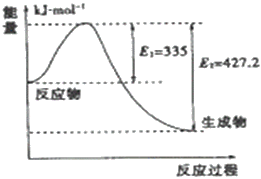
①请计算每生成1moNH3放出热量为___________
②若起始时向容器内放入1moN2和3molH2达平衡后N2的反应体积分数为20%,则反应放出的热量为Q1kJ,则Q1的数值为___________
(5)炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如图所示,活化氧可以快速氧化二氧化硫。下列说法错误的是_______
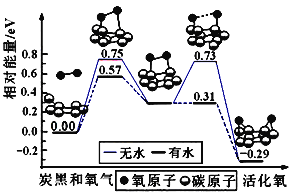
A.氧分子的活化包括O-O键的断裂与C-O键的生成
B.每活化一个氧分子放出0.29eV的能量
C.水可使氧分子活化反应的活化能降低0.42eV
D.炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水氯化铝在生产、生活中应用广泛。
(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为___________。
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3 、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
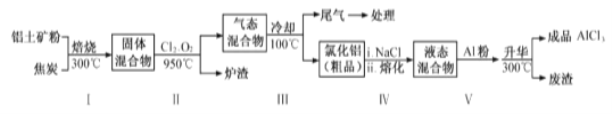
已知:

①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是_____(只要求写出一种)。
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是_____。
③步骤Ⅲ的尾气经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为_________________________。
④结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(含有I2、I-等)中回收碘,其实验过程如下:
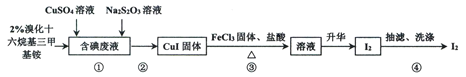
已知:溴化十六烷基三甲基铵是一种阳离子表面活性剂,可以中和沉淀表面所带的负电荷,使沉淀颗粒快速聚集,快速下沉。下列说法不正确的是
A.步骤①中Na2S2O3可用Na2SO3代替
B.步骤②可以用倾析法除去上层清液
C.含碘废液中是否含有IO3-,可用KI-淀粉试纸检验
D.步骤③发生反应的离子方程式为:4Fe3++2CuI![]() 4Fe2++2Cu2++I2
4Fe2++2Cu2++I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com