
| 250 |
| 25 |
| 2.78g |
| 2.85g |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

| 同一反应时间 | 同一反应温度 | ||||
| 反应温度/℃ | 转化率(%) | 选择性(%)* | 反应时间/h | 转化率(%) | 选择性(%)* |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.8 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
| *选择性100%表示反应生成的产物是乙酸乙酯和水 | |||||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Li能在空气中燃烧 |
| B、Li2O熔点较低 |
| C、Li2CO3能溶于水 |
| D、LiOH受热不易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第ⅥA族元素从上到下,其氢化物的稳定性逐渐减弱 |
| B、L层电子数为奇数的所有元素都是非金属元素 |
| C、ⅦA族元素阴离子的还原性越强,元素的最高价氧化物对应水化物的酸性也越强 |
| D、同一主族的甲乙两种元素,甲的原子序数为a,则乙的原子序数可能为a+4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

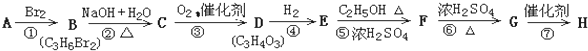
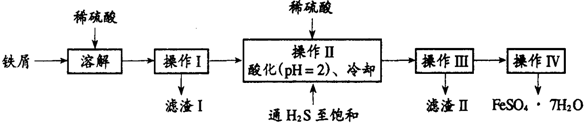
查看答案和解析>>
科目:高中化学 来源: 题型:
 铁砂的主要成分是微粒状的磁性氧化铁、石英、石灰石等混合物.某化学兴趣小组从铁砂中分离出磁性氧化铁,并进行铝热反应实验.
铁砂的主要成分是微粒状的磁性氧化铁、石英、石灰石等混合物.某化学兴趣小组从铁砂中分离出磁性氧化铁,并进行铝热反应实验.查看答案和解析>>
科目:高中化学 来源: 题型:
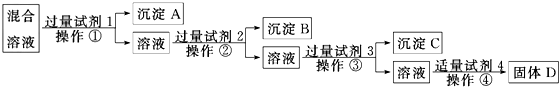
查看答案和解析>>
科目:高中化学 来源: 题型:
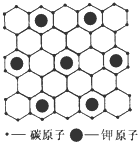 石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层碳原子中.比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CnK,其平面图形见图,则n值为( )
石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层碳原子中.比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CnK,其平面图形见图,则n值为( )| A、4 | B、6 | C、8 | D、12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com