
根据下列实验操作和现象,结论正确的是
| 操作 | 实验现象 | 结论 |
A | 向某溶液中加入氯化钡、稀硝酸的混合液 | 产生白色沉淀 | 该溶液中一定含有SO42-或SO32- |
B | 将某气体通入品红溶液 | 溶液红色褪去 | 该气体一定SO2 |
C | 把湿润的碘化钾——淀粉试纸放入某一红棕色的气体中 | 试纸变蓝色 | 该气体可能是NO2 |
D | 将通入SO2到酸性高锰酸钾溶液中 | 溶液紫色褪去 | SO2具有漂白性 |
科目:高中化学 来源:2015届安徽省高一上学期期中考试化学试卷(解析版) 题型:选择题
下表中评价合理的是
选项 | 化学反应及其离子方程式 | 评价 |
A. | NaHSO4溶液与Ba(OH)2溶液反应至中性: 2H++SO42﹣+Ba2++2OH﹣=BaSO4↓+2H2O | 正确 |
B. | 向碳酸镁中加入足量稀盐酸: MgCO3+2H+=Mg2++CO2↑+H2O | 错误,碳酸镁应拆成离子形式 |
C. | 向沸水中滴加饱和的氯化铁溶液至液体变为红褐色: Fe3++3H2O=Fe(OH)3↓+3H+ | 正确 |
D. | NaOH溶液中通入少量CO2反应:OH﹣+CO2=HCO3﹣ | 正确 |
查看答案和解析>>
科目:高中化学 来源:2015届安徽省高三第一次联考化学试卷(解析版) 题型:填空题
(1)在常温下,0.5mol甲醇在氧气中完全燃烧生成CO2和液态水,放出热量363.3kJ.写出该反应的热化学方程式: _________________________
(2)请设计一个燃料电池:电解质为强碱溶液,Pt作电极,在电极上分别通入甲醇和氧气。通入甲醇的电极应为 极(填“正”或“负”),该电极上发生的电极反应式为 。
(3)用Pt电极电解盛有1L pH=6的硝酸银溶液,如图甲所示,则右边电极上发生的电极反应式为 .
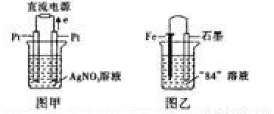
(4)某化学学习兴趣小组为了研究金属的腐蚀现象,将一枚铁钉放在“84”消毒液(NaClO)中,某同学设计了如图乙所示实验装置,写出石墨极上发生的电极反应式:
查看答案和解析>>
科目:高中化学 来源:2015届安徽省皖南八校高三第一次联考化学试卷(解析版) 题型:实验题
(12分)某研究小组为了探究Fe3+与I-的反应是否为可逆反应,设计了如下实验:
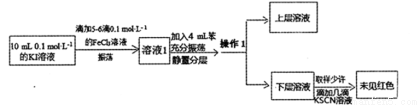
(1)取少量溶液1于试管中,加入少量淀粉溶液,震荡,溶液变蓝,说明Fe3+与I-的反应有______________生成(填化学式)。
(2)上述操作1的名称:______________,所用的主要仪器是_____________,上层溶液的颜色为________________。
(3)该小组对下层溶液滴加KSCN溶液未见红色的原因,提出了下列两种猜想。
猜想一:___________________________;
猜想二:残留的Fe3+与SCN-结合生成的Fe(SCN)3浓度极小,其溶液颜色肉眼无法观察。
为了验证猜想,在查阅资料后,获得下列信息:
Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。
(4)若猜想1成立,请写出该反应的离子方程式:______________;
(5)若猜想2成立,请自行设计实验验证。
实验步骤 | 预期现象与结论 |
|
|
查看答案和解析>>
科目:高中化学 来源:2015届安徽省皖南八校高三第一次联考化学试卷(解析版) 题型:选择题
一般情况下,铜粉不溶于稀硫酸,但添加某物质后,则可反应生成硫酸铜(必要时可以加热)。加入下列物质时,肯定不能促使铜粉溶解的是
A.H2O2 B.FeCl3 C.O2 D.FeCl2
查看答案和解析>>
科目:高中化学 来源:2015届安徽省皖南八校高三第一次联考化学试卷(解析版) 题型:选择题
下列操作能达到实验目的的是
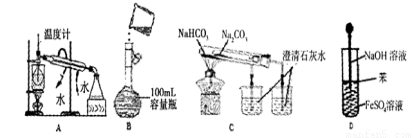
A.分离水和CCl4并回收CCI4
B.定容
C.比较两种盐的热稳定性
D.制取氢氧化亚铁
查看答案和解析>>
科目:高中化学 来源:2015届安徽省江淮十校高三11月联考化学试卷(解析版) 题型:选择题
根据下图海水综合利用的工业流程图,判断下列说法正确的是
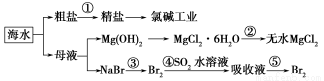
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A.除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.在过程②中将MgCl2·6H2O灼烧即可制得无水MgCl2
C.从能量角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程
D.从第③步到第⑤步的目的是为了浓缩富集溴
查看答案和解析>>
科目:高中化学 来源:2015届宁夏银川市高三上学期期中考试化学试卷(解析版) 题型:填空题
研究性学习小组用Na2SO3与硫酸溶液(硫酸与水体积比1∶1)制备SO2并进行性质探究实验。
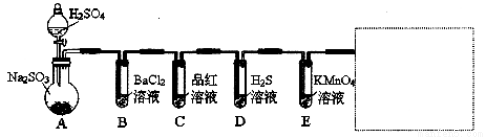
D中的实验现象是 ,C、E中溶液都褪色,分别体现SO2 、 性质。
(2)需在方框中画出 装置, 装置(只填写,不画图)。
(3)研究小组发现B中有白色沉淀,为了清楚沉淀的物质,研究小组往B中加入过量稀盐酸,沉淀不溶解,你认为留下的沉淀物是 ,形成该沉淀的反应方程式有: 。
为了进一步验证沉淀原因,研究小组另取BaC12溶液,加热煮沸,冷却及时加入少量苯液封,然后再通SO2,结果发现沉淀量减少,但仍有轻微浑浊。研究小组改进A装置(如图),再进行实验,B中没有出现浑浊。下列气体可作为X气体的是 (填序号,不定项选择)
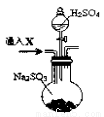
A.CO2 B.NH3 C.O3 D.N2 E.NO2
SO2为空气污染物,研究小组为测定某工厂区空气中SO2的含量,取10m3(标准状况)的空气,缓慢通过足量溴水中,在所得溶液中加入过量的BaC12溶液,将产生的白色沉淀洗涤、干燥,用电子称称其质量为0.233g,则:①沉淀洗涤要干净,检验洗涤已经干净的实验操作是 。
②试计算此空气中SO2的浓度(列出计算表达式并计算结果,结果单位用mg/m3表示) 。
查看答案和解析>>
科目:高中化学 来源:2015届宁夏高三上学期期中考试理科综合化学试卷(解析版) 题型:填空题
现有下列化合物①NaCl、②NaOH、③HCl、④NH4Cl、⑤CH3COONa、⑥CH3COOH、⑦NH3·H2O、⑧H2O,回答问题:
(1)NH4Cl溶液显________性,用离子方程式表示___________ _____________。
(2)已知水中存在如下平衡:H2O+H2O HO+OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,选择的方法是________。
HO+OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,选择的方法是________。
A.向水中加入NaHSO4固体
B.向水中加入Na2CO3固体
C.加热至100 ℃
D.向水中加入(NH4)2SO4固体
(3)若等pH、等体积的②(NaOH)和⑦(氨水)分别加水稀释m倍、n倍,稀释后pH相等,则m________n(填“>”“<”或“=”)。
(4)pH=12的NaOH溶液100mL,要使它的pH为11。(体积变化忽略不计)
如果加入蒸馏水,应加_________mL;如果加入pH=10的NaOH溶液,应加_________mL;
如果加0.01mol/L HCl,应加_________mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com