
 某同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强.他设计了如图装置以验证碳、氮、硅元素的非金属性强弱.该同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成.
某同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强.他设计了如图装置以验证碳、氮、硅元素的非金属性强弱.该同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成.

科目:高中化学 来源: 题型:
| A、硫酸、CuSO4?5H2O、苛性钾 |
| B、硫酸、纯碱、空气 |
| C、氧化铁、胆矾、熟石灰 |
| D、硝酸、烧碱、食盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
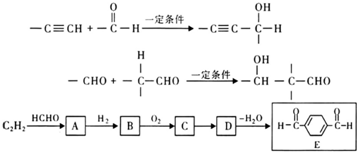
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验方案 | 实验现象与结论 |
| 取少量样品,用稀硫酸溶解后,分成两份: 一份① | ② 滴加KSCN溶液变红色,说明存在. |
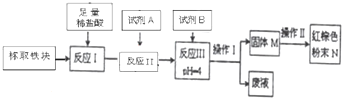
| Fe(OH)2 | Fe(OH)3 | Al(OH)2 | Mg(OH)2 | |
| 开始沉淀的PH | 7.5 | 2.8 | 4.2 | 9.6 |
| 完全沉淀的PH | 9.7 | 4 | 5 | 11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
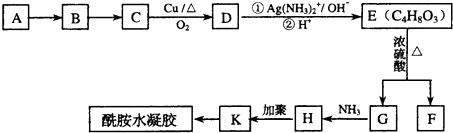
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
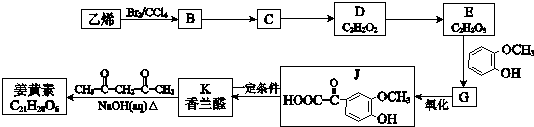

 (R1、R2、R3为烃基或氢原子)
(R1、R2、R3为烃基或氢原子)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用氨水鉴别Al3+、Mg2+、Ag+ |
| B、向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为血红色,该溶液中不一定含有Fe2+ |
| C、NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,用烧碱溶液就可把它们鉴别开来 |
| D、要证明Fe3+溶液中含有Fe2+可以用NH4SCN溶液和氯水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com