
【题目】下列事实不能用勒夏特列原理解释的是( )
A. 由H2、碘蒸气、HI组成的平衡体系加压后颜色变深
B. 黄绿色的氯水光照后颜色变浅
C. 加压可使更多的SO2转化为SO3
D. 在含有Fe(SCN)2+的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去。
【答案】A
【解析】
化学平衡移动的原理也称勒夏特列原理,其内容是:如果改变影响平衡的条件之一(如温度、压强、参加反应的化学物质的浓度)平衡将向着能够减弱这种改变的方向移动。
A. H2、碘蒸气、HI组成的平衡为H2(g)+I2(g)![]() 2HI(g),给平衡体系加压时反应混合气体的体积将减小,各组分的浓度将增大,包括呈紫色的碘蒸气的浓度增大,所以体系的颜色变深,该平衡状态并没有移动,所以由H2、碘蒸气、HI组成的平衡体系加压后颜色变深的事实不能用勒夏特列原理解释,A项正确;
2HI(g),给平衡体系加压时反应混合气体的体积将减小,各组分的浓度将增大,包括呈紫色的碘蒸气的浓度增大,所以体系的颜色变深,该平衡状态并没有移动,所以由H2、碘蒸气、HI组成的平衡体系加压后颜色变深的事实不能用勒夏特列原理解释,A项正确;
B.Cl2呈黄绿色,溶解在水的Cl2分子部分与水反应Cl2+H2O![]() HCl+HClO并达到平衡状态,生成的HClO在光照下发生分解反应2HClO
HCl+HClO并达到平衡状态,生成的HClO在光照下发生分解反应2HClO![]() 2HCl+O2↑,氯水受光照时HClO逐渐分解,HClO浓度减小,根据勒夏特列原理Cl2+H2O
2HCl+O2↑,氯水受光照时HClO逐渐分解,HClO浓度减小,根据勒夏特列原理Cl2+H2O![]() HCl+HClO平衡向正反应方向移动,溶解的Cl2分子逐渐减少,故溶液颜色变浅。所以黄绿色的氯水光照后颜色变浅的事实能用勒夏特列原理解释,B项错误;
HCl+HClO平衡向正反应方向移动,溶解的Cl2分子逐渐减少,故溶液颜色变浅。所以黄绿色的氯水光照后颜色变浅的事实能用勒夏特列原理解释,B项错误;
C.SO2转化为SO3:2SO2+O2![]() 2SO3,生成SO3的方向气体体积减小,根据勒夏特列原理,增大压强平衡向气体体积减小的方向移动,所以加压能使SO2更多地转化为SO3的事实能用勒夏特列原理解释,C项错误;
2SO3,生成SO3的方向气体体积减小,根据勒夏特列原理,增大压强平衡向气体体积减小的方向移动,所以加压能使SO2更多地转化为SO3的事实能用勒夏特列原理解释,C项错误;
D.向该溶液中加铁粉时发生反应2Fe3++Fe=3Fe2+,溶液中Fe3+的浓度减小,根据勒夏特列原理,Fe3++SCN-![]() Fe(SCN)2+平衡向逆反应方向移动,红色粒子Fe(SCN)2+浓度减小,溶液颜色变浅或褪去。所以在含有Fe(SCN)2+的红色溶液中加铁粉,溶液颜色变浅或褪去的事实能用勒夏特列原理解释,D项错误;答案选A。
Fe(SCN)2+平衡向逆反应方向移动,红色粒子Fe(SCN)2+浓度减小,溶液颜色变浅或褪去。所以在含有Fe(SCN)2+的红色溶液中加铁粉,溶液颜色变浅或褪去的事实能用勒夏特列原理解释,D项错误;答案选A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某工厂排放的污水只可能含Na+、K+、NH4+、Mg2+、Fe3+、SO32-、SO42-和Cl-中的几种(忽略由水电离产生的H+、OH-)。将试样平均分成甲、乙、丙各l00mL三份,每次均加入足量的试剂,设计如下实验。下列说法正确的是( )

A. 废水可能含有Na+、K+、Fe3+
B. 可能存在的离子用焰色反应进一步检验确认
C. 废水一定含有Cl-、SO42-和Mg2+,且c(Cl-)=0.2mol·L-1
D. 废水一定不含 SO32-、Cl-、NH4+、Na+、K+、Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的相关数据如下表:
化合物 | 相对分子质量 | 密度 /g·cm-3 | 沸点 /℃ | 溶解度 /100g水 |
正丁醇 | 74 | 0.80 | 118.0 | 9 |
冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |

操作如下:
①在50mL三颈烧瓶中,加入18.5mL正丁醇和13.4mL冰醋酸,3-4滴浓硫酸,投入沸石。安装分水器![]() 作用:实验过程中不断分离除去反应生成的水
作用:实验过程中不断分离除去反应生成的水![]() 、温度计及回流冷凝管。
、温度计及回流冷凝管。
②将分水器分出的酯层和反应液一起倒入分液漏斗中,水洗,10%Na2CO3溶液洗涤,再水洗,最后转移至锥形瓶,干燥。
③将干燥后的乙酸正丁酯滤入烧瓶中,常压蒸馏,收集馏分,得到15.1g乙酸正丁酯。
请回答有关问题:
(1)冷水应该从冷凝管___(填“a”或“b”)端管口通入;
(2)反应中浓硫酸的作用是___;
(3)步骤②中用10%Na2CO3溶液洗涤有机层,该操作的目的是___;
(4)进行分液操作时,使用的漏斗是___(填选项);

(5)步骤③在进行蒸馏操作时,若从118℃开始收集馏分,产率偏__(填“高”或“低”),原因__;
(6)该实验过程中,生成乙酸正丁酯的产率是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若用AG表示溶液的酸度,其表达式为:AG=lg[ ]。室温下,实验室里用0.10mol/L的盐酸溶液滴定10mL0.10mol/LMOH溶液,滴定曲线如图所示,下列说法正确的是( )
]。室温下,实验室里用0.10mol/L的盐酸溶液滴定10mL0.10mol/LMOH溶液,滴定曲线如图所示,下列说法正确的是( )

A. MOH电离方程式是MOH=M++OH-
B. C点加入盐酸的体积为10mL
C. 若B点加入的盐酸溶液体积为5mL,所得溶液中:c(M+)+2c(H+)=c(MOH)+2c(OH-)
D. 滴定过程中从A点到D点溶液中水的电离程度逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备相关物质,涉及的反应原理及部分流程较为合理的是
A. 制取镁:海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
B. 冶炼铝:铝土矿![]() NaAlO2
NaAlO2![]() 无水AlCl3
无水AlCl3![]() Al
Al
C. 制硝酸:N2、H2 ![]() NH3
NH3![]() NO
NO![]() 50%HNO3
50%HNO3 ![]() 浓HNO3
浓HNO3
D. 海带![]() 海带灰
海带灰![]()
![]() I2(aq)
I2(aq)![]() I2
I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于浓硫酸与Cu反应的叙述正确的是( )
A. 在反应中,浓硫酸只表现出氧化性
B. 该反应中还原剂与氧化剂物质的量之比为1:2
C. 在反应中,浓硫酸既表现出氧化性,又表现出酸性
D. 每1 mol 铜参加反应就有2 mol浓硫酸被还原,同时生成2 mol SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含镍(Ni)质量分数约20%废料,主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物。由该废料制备纯度较高的氢氧化镍,工艺流程如下:
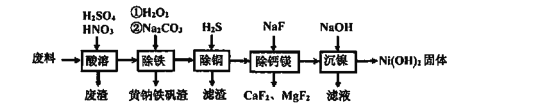
回答下列问题:
(1)合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,反应有N2生成。写出金属镍溶解的化学方程式______________________
(2)“除铁”时H2O2的作用是________________,为了证明添加的H2O2已足量,应选择的试剂是_______________ (填序号:“①铁氰化钾K3[Fe(CN)6]”或“②硫氰化钾KSCN”)溶液.黄钠铁矾[NaxFey(SO4)m(OH)n]具有沉淀颗粒大、沉淀速率快、容易过滤等特点,则x:y:m:n=1:____:2:6
(3)“除铜”时,反应的离子方程式为________________
(4)已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF“除钙镁”后,所得滤液中![]() ________________(保留1位小数)。已知除杂过程在陶瓷容器中进行,NaF的实际用量不宜过大的原因是__________
________________(保留1位小数)。已知除杂过程在陶瓷容器中进行,NaF的实际用量不宜过大的原因是__________
(5)100kg废料经上述工艺制得Ni(OH)2固体的质量为31kg,则镍回收率为______________(保留1位小数)
(6)镍氢电池已成为混合动力汽车的主要电池类型,其工作原理如下:M+Ni(OH)2![]() MH+NiOOH(式中M为储氢合金)。写出电池充电过程中阳极的电极反应式___________
MH+NiOOH(式中M为储氢合金)。写出电池充电过程中阳极的电极反应式___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应速率的说法正确的是:
A. 用铁片和稀硫酸反应制氢气时,改用98%的硫酸可以加快反应速率
B. 100 mL 2 molL﹣1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C. 反应C(s)+H2O(g) ![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,增加C的量 , 其反应速率增大
CO(g)+H2(g)在一可变容积的密闭容器中进行,增加C的量 , 其反应速率增大
D. 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率变慢:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以纯碱溶液为原料,通过电解的方法可制备小苏打,原理装置图如下:
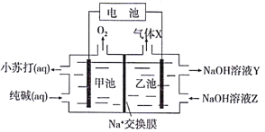
上述装置工作时,下列有关说法正确的是( )
A. 乙池电极接电池正极,气体X为H2
B. Na+由乙池穿过交换膜进入甲池
C. NaOH溶液Z比NaOH溶液Y浓度小
D. 甲池电极反应:4OH--4e-=2H2O+O2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com