
 有A、D、E、G、M、L六种前四周期的元素.A是宇宙中最丰富的元素.D原子核外有1个未成对电子,D+比E原子少一个电子层,E原子得一个电子填入3p轨道后,3p轨道呈全充满状态.G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G的原子序数相差8.L位于周期表第12纵行且是六种元素中原子序数最大的.R是由M、L形成的化合物,其晶胞结构如图所示.请回答下列问题:
有A、D、E、G、M、L六种前四周期的元素.A是宇宙中最丰富的元素.D原子核外有1个未成对电子,D+比E原子少一个电子层,E原子得一个电子填入3p轨道后,3p轨道呈全充满状态.G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G的原子序数相差8.L位于周期表第12纵行且是六种元素中原子序数最大的.R是由M、L形成的化合物,其晶胞结构如图所示.请回答下列问题:分析 有A、D、E、G、M、L六种前四周期的元素,A是宇宙中最丰富的元素,A为氢元素;E原子得一个电子填入3p轨道后,3p轨道呈全充满状态,则E为Cl;D原子核外有1个未成对电子,D+比E原子少一个电子层,则D为Na;G原子的2p轨道有2个未成对电子,原子核外电子排布为1s22s22p4,故G为O元素;M的最高化合价和最低化合价的代数和为4,与G的原子序数相差8,则M为S元素.L位于周期表第12纵行且是六种元素中原子序数最大的,则L为Zn,据此解答.
解答 解:有A、D、E、G、M、L六种前四周期的元素,A是宇宙中最丰富的元素,A为氢元素;E原子得一个电子填入3p轨道后,3p轨道呈全充满状态,则E为Cl;D原子核外有1个未成对电子,D+比E原子少一个电子层,则D为Na;G原子的2p轨道有2个未成对电子,原子核外电子排布为1s22s22p4,故G为O元素;M的最高化合价和最低化合价的代数和为4,与G的原子序数相差8,则M为S元素.L位于周期表第12纵行且是六种元素中原子序数最大的,则L为Zn.
(1)同主族自上而下电负性减小,故元素的电负性G(O)>M(S),故答案为:>;
(2)G为氧元素,它同周期前一族相邻元素为N元素,N原子2p能级容纳3个电子,为半满稳定状态,故氧元素第一电离能比氮元素的小,
故答案为:小;
(3)Cl-的最外层共有8个电子,有8种不同运动状态的电子,最外层电子分属3s、3p 2个能级.S2Cl2广泛用于橡胶工业,在该化合物分子中,所有原子最外层均满足8电子稳定结构,则结构式为Cl-S-S-Cl,则在S2Cl2分子中S原子的杂化类型是sp3,不是对称结构,属于极性分子,
故答案为:8;2;sp3;极性;
(4)SO2分子中S原子价层电子对数为2+$\frac{6-2×2}{2}$=3,VSEPR模型为平面三角形,分子的空间构形为V形,
故答案为:平面三角形;V形;
(5)L为Zn,价电子排布式为3d104s2,该元素位于周期表中ⅡB族,
故答案为:3d104s2;ⅡB;
(6)R是由S、Zn形成的化合物,晶胞中黑色球数目为4,灰色球数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故化学式为ZnS,属于离子晶体,晶胞质量为4×$\frac{87}{{N}_{A}}$g,晶体的密度为ρ g•cm-3,则该晶胞的体积为$\frac{4×\frac{87}{{N}_{A}}}{ρg/c{m}^{3}}$=$\frac{348}{{ρN}_{A}}$cm3,故晶胞边长为$\root{3}{\frac{348}{ρ{N}_{A}}}$cm,
故答案为:ZnS;离子;$\root{3}{\frac{348}{ρ{N}_{A}}}$.
点评 本题是对物质结构的考查,涉及原子核外电子排布、电负性、电离能、杂化方式、空间构型、晶胞计算等,需要学生具备扎实的基础,难度中等.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| A. | 红棕色的NO2气体加压后颜色先变深再变浅 | |
| B. | 打开汽水瓶,看到有大量的气泡逸出 | |
| C. | 二氧化硫转化为三氧化硫时增加空气的量以提高二氧化硫的转化率 | |
| D. | H2、I2、HI混合气体加压后颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
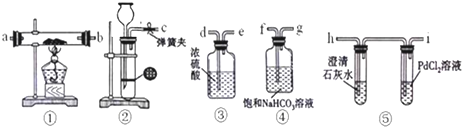
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
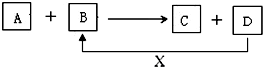 A、B、C、D、X均为中学化学常见的物质.它们之间存在如下图所示转化关系(图中反应条件略去) 填写下列空白:
A、B、C、D、X均为中学化学常见的物质.它们之间存在如下图所示转化关系(图中反应条件略去) 填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol | B. | 1.5mol | C. | 2mol | D. | 3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.44S | B. | 1S | C. | 1.33S | D. | 2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:Na+、Cl-、SCN-、Fe3+ | |
| B. | 碱性溶液中:Na+、AlO2-、Cl-、SO42- | |
| C. | 加入铝粉后产生氢气的溶液中:Ba2+、K+、NO3-、Al3+ | |
| D. | 无色溶液中:Na+、HCO3-、Cl-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的CH4、C2H4、C2H2分别在氧气中完全燃烧,消耗氧气的量依次减少 | |
| B. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| C. | 苯的结构比较稳定,发生取代反应相对比较容易,发生苯环结构被破坏的加成反应困难得多,而氧化反应不能发生 | |
| D. | 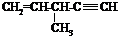 催化加氢可生成3-甲基己烷 催化加氢可生成3-甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液褪色 | B. | 产生白色沉淀 | C. | 无明显现象 | D. | 产生黄色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com