
|
| 2.04×10-3×58.5 |
| 0.6000 |
| 8.30×10-4×103 |
| 0.6000 |


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
| 温度/0C | 250 | 310 | 350 |
| K/(mol/L)2 | 2.041 | 0.250 | 0.012 |
| 浓度mol/L 时间/min | C(CO) | C(H2) | C(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | x | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下11.2LN2含有的分子数为0.5N0 |
| B、9mL水和标准状况下11.2L氮气含有相同的分子数(注水的密度为1g/mL) |
| C、同温同压下,N0个NO与N0个N2和02的混合气体的体积相等 |
| D、25℃、1.01×105Pa时,11.2L氧气所含的原子数目为N0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、如果M溶液呈强酸性,则N溶液中可能含有的阴离子有:OH-、NO3-、CO32- |
| B、如果M溶液呈强碱性,则N溶液中可能含有的阴离子有:MnO4-、AlO2-、SO42- |
| C、如果M溶液具有强还原性,则N溶液中可能含有的阴离子有:MnO4-、NO3-、SO42- |
| D、如果M溶液具有强氧化性,则N溶液中可能含有的阳离子有:K+、Na+、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3:2 | B、2:5 |
| C、3:5 | D、5:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
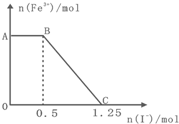 已知酸性高锰酸钾溶液可以将FeSO4氧化,化学反应方程式为:
已知酸性高锰酸钾溶液可以将FeSO4氧化,化学反应方程式为:| A、图中AB段主要是高锰酸钾和碘化钾溶液反应 | ||||
| B、图中BC段发生的反应为2Fe3++2I-═2Fe2++I2通电 | ||||
| C、根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25mol | ||||
D、以Pt为电极材料电解C点的溶液,总反应式为2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
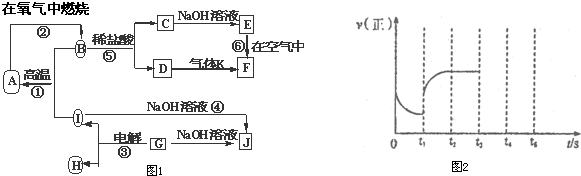
查看答案和解析>>
科目:高中化学 来源: 题型:
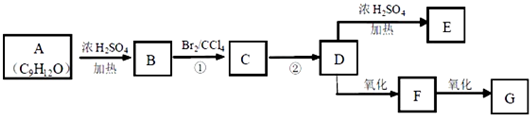
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com