
| A. | 离子化合物一定含共价键 | B. | 共价化合物可能含离子键 | ||
| C. | 离子化合物中只含离子键 | D. | 共价化合物中肯定不含离子键 |
分析 含有离子键的化合物属于离子化合物,离子化合物中可能含有共价键;只含有共价键的化合物属于共价化合物,共价化合物中一定没有离子键,据此分析.
解答 解:A、离子化合物中可能含共价键,如NaOH,也可能不含有共价键,如NaCl,故A错误;
B、共价化合物中只含有共价键,所以共价化合物中一定不含离子键,故B错误;
C、离子化合物中肯定含有离子键,可能含共价键,如NaOH,故C错误;
D、共价化合物中一定不含离子键,故D正确;
故选D.
点评 本题考查了离子键、共价键与离子化合物、共价化合物的关系,侧重考查学生对这几个概念的辨别能力,要注意离子化合物中可能含共价键,共价化合物中一定不含离子键.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下,同浓度的一元酸HA比HB易电离,则相同浓度的NaA溶液比NaB溶液的pH大 | |
| B. | 0.2mol/L,NH4NO3和0.1mol/L NaOH溶液等体积混合后:c(NH4+)>c(NO3-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 物质的量浓度相等的醋酸溶液和氢氧化钠溶液等体积混合:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(CH3COOH) | |
| D. | 同浓度的下列溶液:①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4,其中c(NH4+)由大到小的是:①>②>④>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
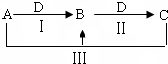 A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去).
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去).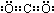
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ②③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
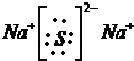 CO2
CO2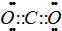
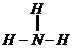
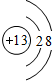 Cl
Cl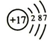 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com