
【题目】(1)Na2O2的电子式____________________
(2)写出“海洋元素”的元素符号__________,该元素单质的苯溶液颜色为______________。
(3)写出木炭与浓硫酸共热时发生的化学反应方程式:_______________________。
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
【题目】2SO2(g) + O2(g) ![]() 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2) / mol | 0.4 | 0.8 | 0.8 |
n(O2) / mol | 0.24 | 0.24 | 0.48 | |
SO2的平衡转化率 / % | 80 | α1 | α2 | |
A. 甲中反应的平衡常数小于乙
B. 平衡时,丙中c(SO3)是甲中的2倍
C. 该温度下,平衡常数值为400
D. 平衡时,甲中O2的转化率大于乙中O2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲被誉为“现代工业、国防与尖端技术的维生素”,工业上常用铜阳极泥(主要成分是Cu2Te,含Ag、Au等杂质)为原料提取碲并回收金属其工艺流程如下:
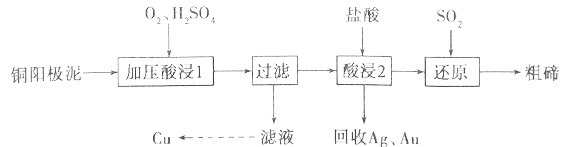
已知:TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱。回答下列问题:
(1)“加压酸浸1”过程中将碲元素转化成TeO2,应控制溶液的pH为4.5~5.0,酸度不能过高,原因是__________________________,其中“加压”的目的是______________________。写出“加压酸浸1”过程中Cu2Te发生反应的化学方程式_________________________________。
(2)“酸浸2”时温度过高会使碲的浸出率降低,原因为______________________。要从Ag和Au中分离出Au,可以向回收的Ag和Au中加入的试剂是______________________。
(3)写出“还原”反应中发生的离子方程式_________________________________。
(4)工业上另一种提取碲的方法是将铜阳极泥在空气中焙烧,使碲转化成TeO2,再加NaOH碱浸,以石墨为电极电解溶液获得Te。电解过程中阴极的电极反应式为_________________________________。
(5)25℃时,向1mol/L的Na2TeO3溶液中滴加盐酸,当溶液pH值约为6时,此时溶液中c(TeO32-):c(HTeO3-)=___________(已知:H2TeO3的Ka1=1.0×10-3,Ka2=2.0×10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L恒容密闭容器中投入一定量的A、B发生反应:3A(g)+bB(g)![]() cC(g) H=-QkJ·mol-1(Q>0),12s时生成C的物质的量为0.8mol(反应进程如图所示)。下列说法中正确的是
cC(g) H=-QkJ·mol-1(Q>0),12s时生成C的物质的量为0.8mol(反应进程如图所示)。下列说法中正确的是
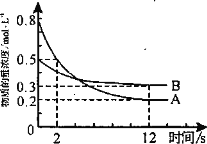
A. 2s时,A的反应速率为0.15mol·L-1·s-1
B. 图中交点时A的消耗速率等于A的生成速率
C. 化学计量数之比b ∶c = 1∶2
D. 12s内反应放出0.2QkJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL FeI2溶液中逐渐通入C12,其中n(I2)、n(Fe3+)随通入n(C12)的变化如图所示,下列说法不正确的是

A. 氧化性强弱:I2<Fe3+
B. n(Cl2)=0.12mol时,溶液中的离子主要有Fe2+、Fe3+、Clˉ
C. 由图可知,该FeI2溶液的浓度为1mol· L-l
D. n(C12):n(FeI2)=1:2时,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E、F的原子序数依次增大,原子核外电子层数之和为13。B的化合物种类繁多,数目庞大;C、D是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期原子半径最小的元素。试回答以下问题:
(1)写出A与D以1∶1的原子个数比形成的化合物的电子式:______________。F的离子结构示意图为_______________________。
(2)B、D形成的化合物BD2中存在的化学键为________键(填“离子”或“共价”,下同)。A、D、E三种元素形成的化合物为____________化合物。
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性。则甲、乙反应的离子方程式为________________________________。
(4)化合物C2A4和C2D4的液体曾被用作火箭推进剂,燃烧反应的生成物是一种气态单质和一种化合物,它们对环境无污染。1 mol C2A4液体和足量C2D4液体完全反应生成两种气体时放出热量516.8 kJ,则该反应的热化学方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于含氮化合物的性质叙述正确的是( )
A.可用铁制容器储存稀硝酸
B.实验室用排空气集气法收集NO气体
C.实验室可用氨水与硫酸铝溶液反应制取氢氧化铝
D.NO2与水发生化合反应生成硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图可以从不同角度研究含氮物质的性质及其转化关系。图中甲~辛均含氮元素。回答下列问题:
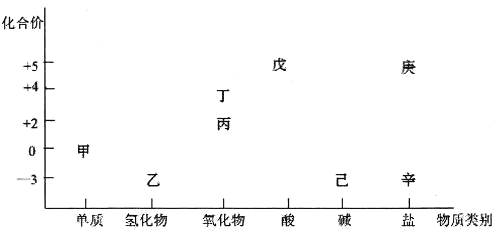
(1)下列给出的图中物质之间的转化可以一步实现的是__________。
A.甲→丁 B.乙→丁 C.丁→戊 D.戊→丙
(2)下列说法正确的是____________。
A.丙和丁在一定条件下都能生成戊,属于酸性氧化物
B.“甲→乙→丙→丁→戊”就是工业制戊的转化过程
C.己和辛在一定条件下都可与固体NaOH作用生成乙,其生成乙的原理相同
D.如果庚和辛为同种物质,则可由乙和戊反应制得
(3)氯碱工业生产中常用乙检查氯气管道是否泄漏,其现象为______________________。已知反应过程中还有甲生成,该反应的化学方程式为______________________________。
(4)已知铁与过量戊的溶液反应,其反应的化学方程式为:Fe+戊→丙+丁+庚+H2O(方程式未配平)。若产物中丙和丁的物质的量之比为1:3,则铁与戊的物质的量之比为_________。若检验庚中铁元素的价态,可选用的试剂为_________,反应的离子方程式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com