
【题目】NA为阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,11.2L的己烷所含的分子数为0.5NA
B.28g乙烯所含共用电子对数目为4NA
C.2.8g 的聚乙烯中含有的碳原子数为0.2 NA
D.1mol 乙醇中含有碳氢键的数目为6 NA
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】下列关于物质工业制备的说法中正确的是
A.接触法制硫酸时,在吸收塔中用水来吸收三氧化硫获得硫酸产品
B.工业上制备硝酸时产生的NOx,一般可以用NaOH溶液吸收
C.从海水中提取镁的过程涉及化合、分解、置换、复分解等反应类型
D.工业炼铁时,常用焦炭做还原剂在高温条件下还原铁矿石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备 Fe(OH)2,装置如右图所示,其中电解池两极材料分别为铁和石墨,通电一段时间后,右侧玻璃管中产生大量的白色沉淀。则下列说法正确的是
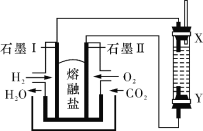
A. 石墨电极Ⅱ处的电极反应式为O2+4e-=2O2-
B. X是铁电极
C. 电解池中有1mol Fe溶解,石墨Ⅰ耗H2 22.4 L
D. 若将电池两极所通气体互换,X、Y两极材料也互换, 实验方案更合理。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绝热容器中发生反应:3Z(s)![]() X(g)+2Y(g)△H=a kJ·mol-1(a>0)。下列说法不正确的是
X(g)+2Y(g)△H=a kJ·mol-1(a>0)。下列说法不正确的是
A.将0.3 mol Z置于容器中充分反应生成气体的物质的量一定小于0.3 mol
B.达到化学平衡状态时,气体平均摩尔质量不变
C.容器中放入3mol Z,达到化学平衡状态时,反应吸收的总热量为a kJ
D.容器温度不变,反应已经达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
B. CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
C. H2O是极性分子,分子中O原子不在2个H原子所连直线的中点处
D. CO2是非极性分子,分子中C原子不在2个O原子所连直线的中点处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某优质甜樱桃中含有一种羟基酸(用M表示),M的碳链结构无支链,分子式为C4H6O5;1.34 g M与足量的碳酸氢钠溶液反应,生成标准状况下的气体0.448 L。M在一定条件下可发生如下转化:M![]() A
A![]() B
B![]() C(M、A、B、C分子中碳原子数目相同)。下列有关说法中不正确的是( )
C(M、A、B、C分子中碳原子数目相同)。下列有关说法中不正确的是( )
A. M的结构简式为HOOC—CHOH—CH2—COOH
B. B的分子式为C4H4O4Br2
C. 与M的官能团种类、数量完全相同的同分异构体还有2种
D. C物质不可能溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为苯和溴取代反应的改进实验装置。其中A为带支管的试管改制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑。向反应容器A中逐滴加入溴和苯的混合液,几秒内就发生反应。
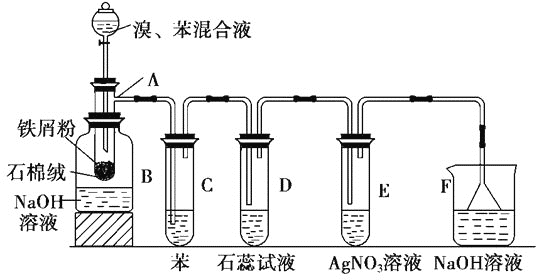
(1)试管C中苯的作用是_____;反应开始后,观察D试管,看到的现象为_____;能说明苯与溴发生的是取代反应而不是加成反应的现象为_____(只需写出一种)。
(2)装置中哪些部分能起到防倒吸的作用,请填序号________________。
(3)改进后的实验除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这三个优点外,还有一个优点是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“一碳化学”是指以含一个碳原子的化合物(如CO2、CO、CH4、CH3OH等)为初始反应物,合成一系列重要的化工原料和燃料的化学。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)![]() NH2COONH4(s) H1
NH2COONH4(s) H1
反应II:NH2COONH4(s)![]() CO(NH2)2(s)+H2O(g) H2=+72.49kJ/mol
CO(NH2)2(s)+H2O(g) H2=+72.49kJ/mol
总反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) H3=-86.98kJ/mol
CO(NH2)2(s)+H2O(g) H3=-86.98kJ/mol
请回答下列问题:
①反应I的H1=__kJ/mol。
②反应II一般在__(填“高温或“低温")条件下有利于该反应的进行。
③一定温度下,在体积固定的密闭容器中按计量比投料进行反应I,下列能说明反应达到了平衡状态的是__(填字母序号)。
A.混合气体的平均相对分子质量不再变化
B.容器内气体总压强不再变化
C.2v正(NH3)=v逆(CO2)
D.容器内混合气体的密度不再变化
(2)将CO2和H2按物质的量之比为1:3充入一定体积的密闭容器中,发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) H。测得CH3OH的物质的量在不同温度下随时间的变化关系如图所示。
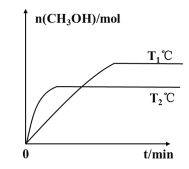
①根据图示判断H__0(填“>”或“<”)。
②一定温度下,在容积均为2L的两个密闭容器中,按如下方式加入反应物,10min后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | amolCO2、bmolH2 cmolCH3OH(g)、cmolH2O(g)(a、b、c均不为零) |
若甲容器平衡后气体的压强为开始时的0.8倍,则反应10min内甲容器中以CH3OH(g)表示的化学反应速率为__,此温度下的化学平衡常数为__(保留两位小数);要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为__。
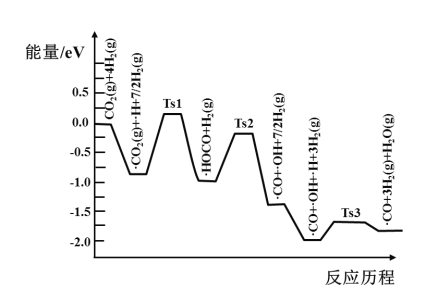
(3)氢气可将CO2还原为甲烷,反应为CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)。ShyamKattel等结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示其中吸附在Pt/SiO2催化剂表面用“·”标注,Ts表示过渡态。物质吸附在催化剂表面,形成过渡态的过程会__(填“放出热量”或“吸收热量”);反应历程中最小能垒(活化能)步骤的化学方程式为__。
CH4(g)+2H2O(g)。ShyamKattel等结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示其中吸附在Pt/SiO2催化剂表面用“·”标注,Ts表示过渡态。物质吸附在催化剂表面,形成过渡态的过程会__(填“放出热量”或“吸收热量”);反应历程中最小能垒(活化能)步骤的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态Fe原子的简化电子排布式为______________________。
(2)常温下,Fe(CO)5为黄色液体,易溶于非极性溶剂。写出CO的电子式______________;Fe(CO)5分子中σ键与π键之比为______________。
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中第一电离能最大的元素是_____________;(SCN)2分子中硫原子的杂化方式是_____________;
(4)硝酸铜溶于氨水形成[Cu(NH3)4](NO3)2的深蓝色溶液。
①[Cu(NH3)4](NO3)2中阴离子的立体构型是_________________。
②与NH3互为等电子体的一种阴离子为_____________(填化学式);氨气在一定的压强下,测得的密度比该压强下理论密度略大,请解释原因__________。
(5)金属晶体可看成金属原子在三维空间中堆积而成,单质铝中铝原子采用铜型模式堆积,原子空间利用率为74%,则铝原子的配位数为________________。
(6)铁和硫形成的某种晶胞结构如右图所示,晶胞参数a=xpm,则该物质的化学式为___________________;A原子距离B原子所在立方体侧面的最短距离为________________pm(用x表示); 该晶胞的密度为____________g·cm-3。(阿伏加德罗常数用NA表示)
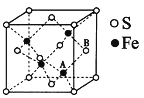
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com