
����Ŀ�����������е�һ�ֳ�����������;�dz��㷺��
��1��FeCl3��Һ���ڸ�ʴͭ��ӡˢ��·��,������Ӧ�����ӷ���ʽΪ___________��
��2������Ƥ��ȡ����۵ľֲ�����ͼ����:
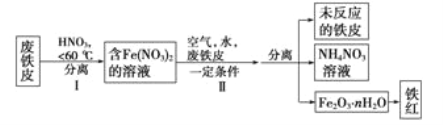
�ٲ���1�¶Ȳ���̫�ߵ�ԭ����____________________________��
�ڲ�����з�����Ӧ��
4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3��nH2O+8HNO3
4Fe+10HNO3==4Fe( NO3)2+NH4NO3+3H20
��һ����Ӧ����������___________������������____________���ڶ�����Ӧÿ����1 molNH4NO3��ת�Ƶĵ�������_________��
����������ں��Ӹֹ�,�䷴Ӧ�Ļ�ѧ����ʽΪ_______________��
����������������,�����е�Ԫ������Ҫ�Ĵ�����ʽΪ__________������ĸ)��
A.�������� B.����� C.�������� D.����
���𰸡� 2Fe3++Cu=2Fe2++Cu2+ �¶�̫�������ֽ� O2 FeO3��nH2O 8NA Fe2O3+2Al![]() Al2O3+2Fe B
Al2O3+2Fe B
����������1��FeCl3��Һ���ڸ�ʴͭ��ӡˢ��·���������Ȼ��������Ȼ�ͭ����Ӧ�����ӷ���ʽΪ2Fe3++Cu=2Fe2++Cu2+����ȷ����2Fe3++Cu=2Fe2++Cu2+��
��2��������ȶ����¶ȸ��������ֽ�����ȷ�𰸣��¶�̫�������ֽ⡣
�ڵ�һ����Ӧ����������������Fe(NO3)2������ΪFe2O3��nH2O������Fe2O3��nH2OΪ��������ڶ�����Ӧ�и�����Ԫ�صļ�̬�仯��֪�÷�Ӧת�Ƶ��ӵ���Ϊ8mol������8 NA ����ת��ʱ������1molNH4NO3����ȷ�𰸣�O2 �� FeO3��nH2O�� 8 NA��
������Ϊ����������������������ȷ�Ӧ�������ں��Ӹֹ�����Ӧ�Ļ�ѧ����ʽΪFe2O3+2Al![]() Al2O3+2Fe����ȷ����Fe2O3+2Al
Al2O3+2Fe����ȷ����Fe2O3+2Al![]() Al2O3+2Fe��
Al2O3+2Fe��
��ͨ������ͼ��֪�����������������������������е�Ԫ������Ҫ�Ĵ�����ʽ����ȷѡ��B ��


 �������ͬ����ϰϵ�д�
�������ͬ����ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڹ�ҵ��������Ҫ����;��ij��ȤС����ʵ������ģ�ҵ���������Ʊ���ˮ�Ȼ�������ˮAlCl3��183������������ʪ������������������������������װ���Ʊ���
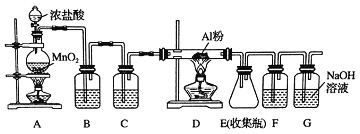
��1��װ��B��ʢ��_____��Һ����������_____��F�е���_____��Һ����������_____����һ������װ���ʵ��Լ���Ҳ����F��G�����ã���װ����Լ�Ϊ_____��
��2��װ��Aʵ�鿪ʼʱ���ȼ��װ�������ԣ��������IJ���������_____������ţ���
A������ƿ�м���MnO2��ĩ B������ C������ƿ�м���Ũ����
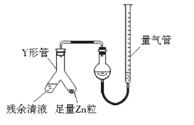
��3���Ʊ���Ӧ��������Ũ���½���ֹͣ��Ϊ�ⶨ��Ӧ����Һ�������Ũ�ȣ�̽��С��ͬѧ����ܶ�ʵ�鷽�������з���֮һΪ�ò�����Һ��������Zn��Ӧ���������ɵ�H2�����װ������ͼ��ʾ���г���������ȥ����
��ʹY�ι��еIJ�����Һ��п����Ӧ����ȷ�����ǽ�_____ת�Ƶ�_____�У�
�ڷ�Ӧ��ϣ�ÿ���1���Ӷ�ȡ������������������С��ֱ�����䣮���������μ�С��ԭ����_____���ų�������ʵ�������Ӱ�����أ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij̽��С�����ñ�ͪ�������Ӧ(CH3COCH3��Br2![]() CH3COCH2Br��HBr)���о���Ӧ��Ũ���뷴Ӧ���ʵĹ�ϵ����Ӧ���� v(Br2) ͨ���ⶨ�����ɫ��ʧ�����ʱ����ȷ������һ���¶��£��������ʵ�����ݣ�
CH3COCH2Br��HBr)���о���Ӧ��Ũ���뷴Ӧ���ʵĹ�ϵ����Ӧ���� v(Br2) ͨ���ⶨ�����ɫ��ʧ�����ʱ����ȷ������һ���¶��£��������ʵ�����ݣ�
ʵ����� | ��ʼŨ��c/mol��L��1 | ����ɫ��ʧ����ʱ��t/s | ||
CH3COCH3 | HCl | Br2 | ||
�� | 0.80 | 0.20 | 0.0010 | 290 |
�� | 1.60 | 0.20 | 0.0010 | 145 |
�� | 0.80 | 0.40 | 0.0010 | 145 |
�� | 0.80 | 0.20 | 0.0020 | 580 |
����ʵ���������ó��Ľ�������ȷ����(����)
A������c(CH3COCH3)��v(Br2)����
B��ʵ��ں͢۵�v(Br2)���
C������c(HCl)��v(Br2)����
D������c(Br2)��v(Br2)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijЩ������е�������a.�д̼�����ζ��b.����ˮ��Ӧʹ��Һ�����ԣ�c.��ʹ���۵⻯����Һ���������и��������������ȫ���������ǣ� ��
A.NO2��SO2B.NH3��NO2C.NO2��Cl2D.Cl2��SO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���������ɳ�����չ�������,��Դ�������������Լ��ճ�����ȶ��벻����ѧ��
��1���������ǽ������ϵ����ǡ���ٳ�һ�ֺ���Ԫ�صIJ�������:__________��
��2��������Ũ��ˮ�����������ܵ��Ƿ�©�����ô˷������۲쵽��������___________��
��3��ijУ������ȤС���ڴ�����ˮ��Ʒʱ���轫��������Ϊ37%��Ũ����(�ܶ�Ϊ1.19g��cm-3)���Ƴ�250mL0.1mol��L-1�����ᡣ
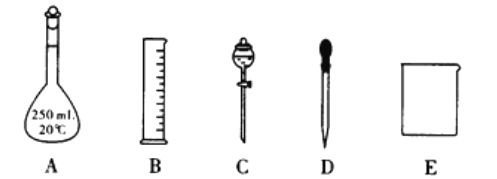
������ͼ��ʾ������,����������ԭ����Ҫ����________������ĸ)����ͼ������������,����������Һ����Ҫ�IJ���������_______________��
��������ʱ������������ȷ,�ձ�û��ϴ��,��������Һ�����ʵ���Ũ��_________(�ƫ�ߡ�,��ƫ�͡�����Ӱ�족,��ͬ)������ʱ����,��������Һ�����ʵ���Ũ��_______��
��4������Ʒ��������һ����������Ĥ����������,��������Ĥ�ױ��ᡢ���ƻ����������������������Ƶ���Һ����,��Ӧ�����ӷ���ʽΪ______________________��
��5����ҵ����������(��SiO2������)����������Na2SiO3��NaAlO2�����Һ���Ƶ�Al(OH��3,��Ҫ�������Լ���ѡ������,���ѡ�õ��Լ������__________������ĸ)��
a.NaOH��Һ b.��ˮ c.CO2 d.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�������Ҫ�Ļ���ԭ�ϣ��ֿ���Ϊȼ�ϣ����úϳ�������Ҫ�ɷ�ΪCO��CO2��H2���ڴ����������ºϳɼ״�����������Ҫ��Ӧ���£�
��CO��g��+2H2��g��![]() CH3OH��g�� ��H1
CH3OH��g�� ��H1
��CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g�� ��H2
CH3OH��g��+H2O��g�� ��H2
��CO2��g��+H2��g��![]() CO��g��+H2O��g�� ��H3
CO��g��+H2O��g�� ��H3
�ش��������⣺
��1����֪��Ӧ���е���صĻ�ѧ�������������£�
��ѧ�� | H��H | C��O | C��O | H��O | C��H |
E/( kJmol-1) | 436 | 343 | 1076 | 465 | 413 |
�ɴ˼�����H1=______����֪��H2=��58 kJmol-1������H3=______��
��2���ϳ����е������Ƿ�չ�е�����Դ���������ð����Ʊ��������Ӧ���������ڡ���������ȣ�������Ϊȼ�ϵ��ŵ���__________________________________________________________��д�����㣩��ȱ����______________________________________________________________________��д�����㣩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��д��ȷ����(����)
A. �Ȼ�����Һ�м��������ˮ��Al3++4NH3��H2O![]() AlO2-+4NH4++2H2O
AlO2-+4NH4++2H2O
B. ����ʯ��ˮ�������մ���Һ��ϣ�Ca2++OH-+HCO3-![]() CaCO3��+H2O
CaCO3��+H2O
C. ̼������ڴ��CaCO3+2H+![]() Ca2++CO2��+H2O
Ca2++CO2��+H2O
D. �Ȼ�������Һ��ͨ��������2Fe2++Cl2![]() 2Fe3++2Cl-
2Fe3++2Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ�����Ӧ�������������
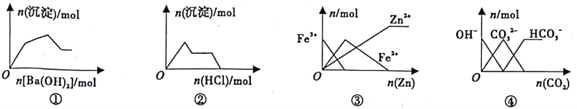
A. ͼ�ٱ�ʾ��KAl(SO4)2��Һ����μ���Ba(OH)2��Һ
B. ͼ�ڱ�ʾ��NaAlO2�ܲ�����μ�������
C. ͼ�۱�ʾ��FeCl3��Һ�м���п��
D. ͼ�ܱ�ʾ��NaOH��Һͨ��CO2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com