
| A. | 浓H2SO4和浓HCl在空气中敞口放置时浓度均减小 | |
| B. | SO2和Cl2均能使品红溶液褪色 | |
| C. | 浓H2SO4和稀硫酸与锌反应均生成气体 | |
| D. | 浓H2SO4、浓HNO3均可以用铁制容器贮存 |
分析 A.浓硫酸具有吸水性,盐酸易挥发;
B.二氧化硫与有色物质发生化合反应,氯水中的次氯酸具有强氧化性而是有色物质漂白;
C.浓硫酸与锌反应生成硫酸锌和二氧化硫和水,稀硫酸与锌反应生成硫酸锌和氢气;
D.浓H2SO4、浓HNO3都具有强的氧化性.
解答 解:A.浓硫酸具有吸水性,盐酸易挥发,二者防止空气中浓度都变小,但原理不同,故A不选;
B.二氧化硫与有色物质发生化合反应,氯水中的次氯酸具有强氧化性而是有色物质漂白,二者漂白原理不同,二氧化硫的漂白不稳定,加热可恢复到原来的颜色,故B不选;
C.浓硫酸与锌反应生成硫酸锌和二氧化硫和水,稀硫酸与锌反应生成硫酸锌和氢气,二者反应实质不同,故C不选;
D.浓H2SO4、浓HNO3均可以用铁制容器贮存,都体现强的氧化性,原理相同,故D选;
故选:D.
点评 本题考查了元素化合物知识,熟悉相关物质的性质是解题关键,侧重考查学生对基础知识掌握的熟练程度,题目难度不大.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 向水中加入稀氨水,平衡逆向移动,c(OH-)减小,c(H+)减小 | |
| B. | 将水加热,KW增大,pH变小 | |
| C. | 向水中加入少量HCl气体,平衡逆向移动,c(H+)减小,c(OH-)减小 | |
| D. | 向水中加入少量固体硫酸氢钠,c(H+)增大,KW变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
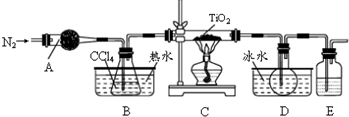
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2+HCl;KOH+H2SO4 | B. | KHCO3+HNO3;K2CO3+HNO3 | ||
| C. | NaHCO3+H2SO4; Ba(HCO3)2+H2SO4 | D. | CuCl2+NaOH;CuSO4+NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
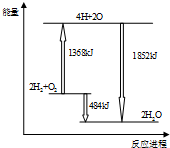
| A. | 拆开2mol H2(g)和1mol O2(g)中的化学键成为H、O原子,共放出1368kJ能量 | |
| B. | 由H、O原子形成2mol H2O(g),共吸收1852 kJ能量 | |
| C. | 2molH2(g)和1mol O2(g) 反应生成2mol H2O(l),共吸收484kJ能量 | |
| D. | 2molH2(g)和1mol O2(g)反应生成2mol H2O(g),共放出484kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷中的乙烯(酸性高锰酸钾溶液,洗气) | |
| B. | 溴苯中的溴(水,分液) | |
| C. | 乙烯中的SO2(溴水,洗气) | |
| D. | 乙醇中的水(CaO,蒸馏) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义.
氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100体积的水和100体积的酒精混合,所得混合溶液的体积等于200体积 | |
| B. | 串联电路中电流大小处处相等 | |
| C. | 稀盐酸和氢氧化钠溶液混合后,所得溶液质量与反应前溶液的总质量相等 | |
| D. | 在化学反应中,反应物的原子种类和总数等于生成物的原子种类和总数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com