
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、乙烷与氯气在光照条件下的反应 |
| B、乙烯使酸性高锰酸钾溶液褪色 |
| C、己烷与溴水混合振荡,静置后溴水层褪色 |
| D、在催化剂作用下,乙烯和水反应生成乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化钠溶液在电流作用下电离成Na+与Cl? |
| B、溶于水后能电离出H+的化合物都是酸 |
| C、氯化氢溶于水后能导电,但液态氯化氢不能导电 |
| D、导电性强的溶液中自由移动离子数目一定比导电性弱的溶液中自由移动离子数目多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、-(6-3n) |
| B、-(8-n) |
| C、-(12-3n) |
| D、-(14-5n) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
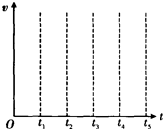 (1)按要求写出下列反应方程式:
(1)按要求写出下列反应方程式: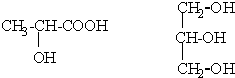
查看答案和解析>>
科目:高中化学 来源: 题型:
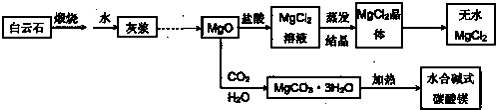
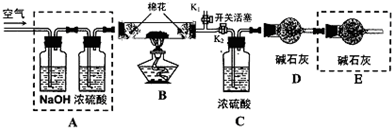
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(H2O) |
| n(CH4) |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com