
【题目】天然石灰石是工业生产中重要的原材料之一,它的主要成分是 CaCO3,一般以CaO 的质量分数表示钙含量,常采用高锰酸钾法测定。步骤如下:
Ⅰ.称取 a g 研细的石灰石样品于 250 mL 烧杯中,加过量稀盐酸溶解,水浴加热 10 分钟;
Ⅱ.稍冷后逐滴加入氨水至溶液 pH≈4,再缓慢加入适量(NH4)2C2O4 溶液,继续水浴加热30 分钟;
Ⅲ.冷却至室温后过滤出沉淀,用另外配制的稀(NH4)2C2O4 溶液洗涤沉淀三次,再用蒸馏水洗涤至洗涤液中无法检出 Cl;
Ⅳ.加入适量热的稀硫酸至沉淀中,获得的溶液用 c mol·L1 KMnO4 标准溶液滴定至终点。
Ⅴ.平行测定三次,消耗KMnO4 溶液的体积平均为 V mL。
已知:H2C2O4 是弱酸;CaC2O4 是难溶于水的白色沉淀。
⑴Ⅰ中为了加快反应速率而采取的操作有_____。
⑵Ⅱ中加入氨水调节溶液 pH 的作用是_____。
⑶Ⅲ中洗涤得到干净的沉淀。
①结合平衡移动原理,解释用稀(NH4)2C2O4 溶液洗涤沉淀的目的__________________________。
②检测洗涤液中无 Cl的试剂和现象是__________________________。
③若沉淀中的 Cl未洗涤干净,则最终测量结果_____(填“偏大”、“偏小”或“不变”)。
⑷Ⅳ中用 KMnO4 标准溶液滴定。
①滴定时发生反应的离子方程式为_____。
②滴定至终点的现象为_____。
③样品中以CaO 质量分数表示的钙含量为_____(列出表达式)。
【答案】将石灰石粉碎、搅拌,适当升高温度等 避免酸性过强,生成的草酸钙溶于酸 增加草酸根浓度,CaC2O4(s)![]() Ca2+(aq) + C2O42(aq),抑制草酸钙溶解平衡 取最后一次洗涤液于试管,加入稀硝酸和硝酸银,如有白色沉淀,则未洗净,若无现象,则洗净 偏大 5H2C2O4+ 2MnO4-+8 H+=2Mn2++ 10CO2↑+ 8H2O 当滴入最后一滴溶液,溶液由无色变为紫红色,且半分钟不变为原来的颜色
Ca2+(aq) + C2O42(aq),抑制草酸钙溶解平衡 取最后一次洗涤液于试管,加入稀硝酸和硝酸银,如有白色沉淀,则未洗净,若无现象,则洗净 偏大 5H2C2O4+ 2MnO4-+8 H+=2Mn2++ 10CO2↑+ 8H2O 当滴入最后一滴溶液,溶液由无色变为紫红色,且半分钟不变为原来的颜色 ![]()
【解析】
将研细的石灰石溶于过量的稀盐酸中,充分反应后,逐滴加入氨水,降低酸性,再缓慢加入适量(NH4)2C2O4溶液,反应生成草酸钙沉淀并过滤,用稀(NH4)2C2O4 溶液洗涤沉淀,加入适量热的稀硫酸,得到草酸溶液,再用KMnO4 标准溶液滴定至终点。
⑴Ⅰ中为了加快反应速率而采取的操作有将石灰石粉碎、搅拌,适当升高温度等;故答案为:将石灰石粉碎、搅拌,适当升高温度等。
⑵稍冷后逐滴加入氨水至溶液 pH≈4,再适量(NH4)2C2O4溶液,说明Ⅱ中加入氨水调节溶液pH的作用是避免酸性过强,生成的草酸钙溶于酸;故答案为:避免酸性过强,生成的草酸钙溶于酸。
⑶①根据平衡移动原理可知,用稀(NH4)2C2O4 溶液洗涤沉淀的目的是增加草酸根离子浓度,CaC2O4(s)![]() Ca2+(aq) + C2O42(aq),抑制草酸钙溶解平衡;故答案为:增加草酸根浓度,CaC2O4(s)
Ca2+(aq) + C2O42(aq),抑制草酸钙溶解平衡;故答案为:增加草酸根浓度,CaC2O4(s)![]() Ca2+(aq) + C2O42(aq),抑制草酸钙溶解平衡。
Ca2+(aq) + C2O42(aq),抑制草酸钙溶解平衡。
②检测洗涤液中无 Cl-的试剂和现象是取最后一次洗涤液于试管,加入稀硝酸和硝酸银,如有白色沉淀,则未洗净,若无现象,则洗净;故答案为:最后一次洗涤液于试管,加入稀硝酸和硝酸银,如有白色沉淀,则未洗净,若无现象,则洗净。
③若沉淀中的Cl-未洗涤干净,则溶于稀硫酸后,再用KMnO4标准溶液滴定,Cl-与高锰酸钾溶液反应,因此消耗的KMnO4标准溶液增大,计算出的草酸根物质的量增大,则最终测量结果偏大;故答案为:偏大。
⑷①滴定时草酸溶液与酸性高锰酸钾反应,发生的离子方程式为5H2C2O4+ 2MnO4-+8 H+=2Mn2++ 10CO2↑+ 8H2O;故答案为:5H2C2O4+ 2MnO4-+8 H+=2Mn2++ 10CO2↑+ 8H2O。
②滴定至终点的现象为当滴入最后一滴溶液,溶液由无色变为紫红色,且半分钟不变为原来的颜色;故答案为:当滴入最后一滴溶液,溶液由无色变为紫红色,且半分钟不变为原来的颜色。
③样品中![]() ,则CaO 质量分数表示的钙含量为
,则CaO 质量分数表示的钙含量为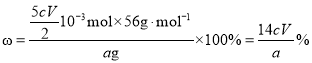 ;故答案为:
;故答案为:![]() 。
。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】绿原酸是一种新型高效的酚型天然抗氧化剂,在食品行业有着广泛的用途。其在酸性条件下发生如下反应,下列有关说法不正确的是
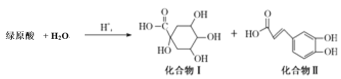
A.上述变化发生取代反应
B.1mol化合物I与足量金属钠反应生成标准状况下氢气体积为56L
C.1mol化合物II与浓溴水反应时,消耗4molBr2
D.1mol化合物II与足量的Na2CO3反应得到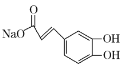
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究第ⅦA族元素原子的得电子能力强弱规律。下图中A、B、C是三个可供选择制取氯气的装置,装置D的玻璃管中①②③④处依次放置蘸有NaBr溶液、淀粉碘化钾溶液、NaOH浓溶液和品红溶液的棉球。
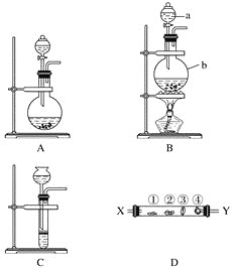
(1)写出装置B中指定仪器的名称a________,b_________。
(2)实验室制取氯气还可采用如下原理:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。依据该原理需要选择A、B、C装置中的________装置制取氯气。
(3)反应装置的导气管连接装置D的________(填“X”或“Y”)导管,试回答下列问题
①处所发生反应的离子方程式:____________________;
②处的现象:____________________;
③处所发生反应的离子方程式:__________________________。
(4)装置D中④的作用是__________________。
(5)某同学根据①②两处棉球颜色的变化得出结论:Cl、Br、I原子的得电子能力依次减弱。上述实验现象________(填“能”或“不能”)证明该结论、理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe3O4的混合物中加入100mL2mol/L的盐酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是( )
A. 11.2gB. 5.6gC. 2.8gD. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究Na2SO3溶液和KIO3溶液的反应。
实验I:向某浓度的KIO3酸性溶液(过量)中加入Na2SO3溶液(含淀粉),一段时间(t秒)后,溶液突然变蓝。
资料:IO3-在酸性溶液氧化I-,反应为IO3- + 5I- + 6H+ = 3I2 + 3H2O
(1)溶液变蓝,说明Na2SO3具有_________性。
(2)针对t秒前溶液未变蓝,小组做出如下假设:
i.t秒前未生成I2,是由于反应的活化能______(填“大”或“小”),反应速率慢导致的。
ii.t秒前生成了I2,但由于存在Na2SO3,_____(用离子方程式表示),I2被消耗。
(3)下述实验证实了假设ii合理。
实验II:向实验I的蓝色溶液中加入_______,蓝色迅速消失,后再次变蓝。
(4)进一步研究Na2SO3溶液和KIO3溶液反应的过程,装置如下。
实验III:K闭合后,电流表的指针偏转情况记录如下表:
表盘 | |
| ||
时间/min | 0~t1 | t2~t3 | t4 | |
偏转 位置 | 右偏至Y | 指针回到“0”处,又返至“X”处;如此周期性往复多次…… | 指针 归零 | |
① K闭合后,取b极区溶液加入盐酸酸化的BaCl2溶液,现象是______。
② 0~t1时,从a极区取溶液于试管中,滴加淀粉溶液,溶液变蓝;直接向a极区滴加淀粉溶液,溶液未变蓝。判断IO3- 在a极放电的产物是_______。
③ 结合反应解释t2~t3时指针回到“0”处的原因:________。
(5)综合实验I、II、III,下列说法正确的是_______。
A.对比实验I、II,t秒后溶液变蓝,I中SO32-被完全氧化
B.对比实验I、III,t秒前IO3- 未发生反应
C.实验III中指针返回X处的原因,可能是I2氧化SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几个反应:①向NaAlO2溶液中滴加盐酸;②向盐酸和AlCl3的混合溶液中滴加NaOH溶液;③向NaOH溶液中滴加AlCl3溶液;
⑴符合反应①的图象是______,符合反应②的图象是_____,符合反应③的图象是____;
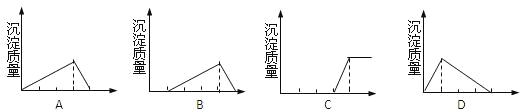
(2)写出③步骤中的二个离子方程式__________________、________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将有铜的印刷线路板浸入200 mL氯化铁浓溶液中,有19.2 g铜被腐蚀掉。取出印刷线路板,向溶液中加入16.8 g铁粉,经充分反应,溶液中还存在9.6 g不溶解的物质。(设溶液体积不变)。请回答下列问题:
(1)充分反应后,溶液中存在9.6 g不溶物的成分为____。
(2)充分反应后溶液中一定不存在的金属离子为_____。
(3)比较Fe2+、Fe3+、Cu2+的氧化性大小:______。
(4)试计算最后溶液中Fe2+的物质的量浓度____mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蛋白质是生命的物质基础。某学习小组通过实验探究一种蛋白质的元素组成。
I.确定该蛋白质中的某些组成元素
(1)为确定该蛋白质中含氮元素,要将样品中有机氮转化成铵盐。能证明铵根存在的离子方程式是__。
(2)为确定该蛋白质中含碳、氢、硫三种元素,采用如图装置进行探究,通入氧气使样品在装置A中充分燃烧,并使其产物依次缓缓通过其余装置。

①装置B中的试剂是________。
②装置D的作用是_______。
③当装置B、C、E、F依次出现下列现象:_____,品红溶液褪色,_____,出现白色浑浊;可证明燃烧产物中含有H2O、SO2、CO2,结论:该蛋白质中含碳、氢、硫、氮等元素。
II.为测定该蛋白质中硫元素的质量分数,小组取蛋白质样品充分燃烧,先用足量碘水吸收二氧化硫,再取吸收液,以淀粉为指示剂,用硫代硫酸钠溶液滴定过量的碘,已知:2![]() +I2===
+I2===![]() +2I-。
+2I-。
(3)写出二氧化硫与碘水反应的化学方程式:_______。
(4)达到滴定终点的标志为________。
(5)取蛋白质样品m g进行测定,采用c1 mol·L-1的碘水V1 mL进行吸收,滴定过量的碘样时消耗c2 mol·L-1硫代硫酸钠溶液V2 mL。该蛋白质中的硫元素的质量分数为______。
(6)若燃烧时过量氧气进入吸收液中,可能会导致该蛋白质中的硫元素的质量分数测定值______(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置从含NH4H2PO4和(NH4)2HPO4的废水中回收NH3·H2O和H3PO4,下列说法错误的是( )

A.电源中X和Y两电极的电势X比Y低
B.膜1为阳离子交换膜,f口放出的是O2
C.阳极区反应之一为:2H2O-4e-+2HPO![]() =O2↑+2H3PO4
=O2↑+2H3PO4
D.每放出11.2L(标准状况下)H2时,能回收98gH3PO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com