
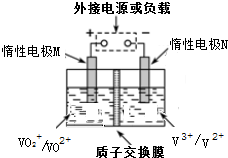
 全钒液流储能电池是以溶解于一定浓度硫酸溶液中不同价态钒离子的氧化还原反应来实现化学能和电能相互转化,充电时,惰性电极M、N分别连接电源的正极和负极.电池工作原理如图所示,下列说法不正确的是( )
全钒液流储能电池是以溶解于一定浓度硫酸溶液中不同价态钒离子的氧化还原反应来实现化学能和电能相互转化,充电时,惰性电极M、N分别连接电源的正极和负极.电池工作原理如图所示,下列说法不正确的是( )| A. | 放电过程中,M电极反应为V02++2H++e一=V02++H20 | |
| B. | 放电过程中,质子通过交换膜从负极区移向正极区 | |
| C. | 充电过程中,N电极上V3+被还原为V2+ | |
| D. | 充电过程中,M电极附近酸性减弱 |
分析 充电时,左槽发生的反应为VO2++H2O═VO2++2H++e-,放电时正极上反应式:VO2++2H++e-═VO2++H2O,充电时,阴极上发生得电子的还原反应,即V3++e-═V2+,放电池负极发生V2+-e-═V3+,以此解答该题.
解答 解:A.放电时M为正极,反应式:VO2++2H++e-═VO2++H2O,故A正确;
B.放电过程中,阳离子向正极移动,即由负极区向正极区移动,故B正确;
C.充电时,阴极上发生得电子的还原反应,即V3++e-═V2+,故C正确;
D.充电时,左槽发生的反应为VO2++H2O═VO2++2H++e-,酸性增强,故D错误;
故选D.
点评 本题考查了化学电源新型电池,为高频考点,根据充放电时各个电极上得失电子来分析解答,难点是电极反应式的书写,要根据电解质溶液酸碱性书写,难度中等.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X>Y>Z | |
| B. | 阴离子的还原性:W>X>Y | |
| C. | 气态氢化物的沸点:Y<W | |
| D. | 元素X与Z形成的两种化合物中,X的化合价相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
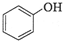
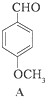 $→_{H+}^{KMnO_{4}}$[B]$→_{浓硫酸,△}^{CH_{3}OH}$
$→_{H+}^{KMnO_{4}}$[B]$→_{浓硫酸,△}^{CH_{3}OH}$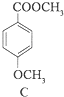
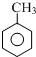 $\stackrel{KMnO_{4}(H+)}{→}$
$\stackrel{KMnO_{4}(H+)}{→}$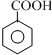
 .
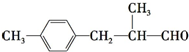
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使溴水褪色的物质一定能和溴水发生加成反应 | |
| B. | 天然蛋白质水解的最终产物是多种α-氨基酸 | |
| C. | 能发生银镜反应的物质都是醛 | |
| D. | 棉花和蚕丝的主要成分都是蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铝在生产、生活中得到广泛的应用,主要是因为其可用热还原法冶炼 | |
| B. | 对“地沟油”蒸馏可以获得汽油 | |
| C. | 氯气常用于自来水的消毒,是利用了氯气的强氧化性来杀菌消毒 | |
| D. | 化石燃料使用过程中排放的硫、氮的氧化物是形成酸雨的主要原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
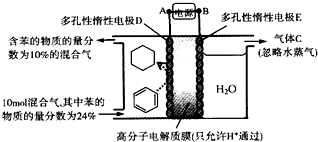
| A. | 多孔性惰性电极E为电解池的阴极 | |
| B. | 装置中气体C为氢气 | |
| C. | 由A至D,导线中电子转移方向为D→A | |
| D. | 装置中阴极的电极反应式为C6H6+6H++6e-═C6H12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
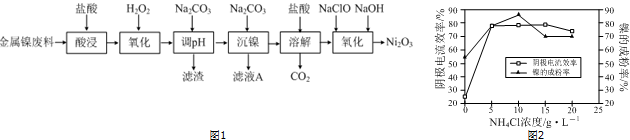
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com